11月26日,国际学术期刊EMBO Journal在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)朱学良研究组的最新研究成果“Rabl2 GTP hydrolysis licenses BBSome-mediated export to fine-tune ciliary signaling”。该研究揭示了一个纤毛特异性的小GTP酶Rabl2对膜蛋白运出纤毛的重要调控作用。
纤毛(cilium)是一种在人体内广泛分布、突出于细胞表面的富含微管的毛发状细胞器,不仅能通过摆动产生力,还能作为细胞的“天线”感知胞外的生物信号(如Hedgehog信号分子)、化学信号(如气味分子)和物理信号(如光和机械力)。G蛋白偶联受体等信号分子在纤毛中的定位和向外运输与其信号通路的激活程度密切相关,而这些过程的异常会导致发育缺陷和多囊肾、多指/趾、智力低下、肥胖、心血管病和骨骼发育异常等遗传疾病,统称纤毛病。BBSome是由8个在-巴德-毕氏综合征(Bardet-Biedl syndrome, BBS)中突变的蛋白质组成的复合物。它通过结合鞭毛内运输(intraflagellar transport,IFT)复合物和纤毛内的膜蛋白,介导膜信号分子的负向运输并使其能随分子马达Dynein驱动的IFT列车(IFT train)穿越纤毛的屏障——转接区(transition zone)。
尽管纤毛介导的信号通路具有重要的生物学功能,但其精细调控机制还不清楚。研究人员发现,与之前报道的人类Rabl2不同,小鼠的Rabl2并不影响纤毛发生。而且,发现GTP结合形式的Rabl2与IFT复合物一起进入纤毛,并在IFT列车穿出转接区的过程中造成BBSome及其膜蛋白“货物”的脱落,导致它们在纤毛内积累。只有当Rabl2将其GTP水解成GDP并因此从IFT复合物上解离后,BBSome及其货物才能高效地穿出转接区。缺乏Rabl2或表达不能水解GTP的突变体Rabl2Q80L均导致Hedgehog信号的异常,前者使小鼠表现出雄性不育、肥胖、多趾和视网膜退行性病变等表型,而后者导致新生鼠死亡和肾脏发育异常等表型。因此,Rabl2的这一开关功能精细地调控了纤毛介导的信号传递,保障了个体发育和自稳态维持的正常。
中国科学院分子细胞科学卓越创新中心段世超博士、博士研究生李昊和张毅荣博士为该论文共同第一作者,鄢秀敏研究员和朱学良研究员为该论文共同通讯作者。该研究得到了分子细胞卓越中心李劲松研究员和博士研究生杨苏明的大力协助。该研究得到国家重点研发计划项目、国家自然科学基金以及中国科学院战略性先导科技专项的资助。该项研究得到分子细胞卓越中心动物实验技术平台、细胞分析技术平台、分子生物学技术平台的大力支持。
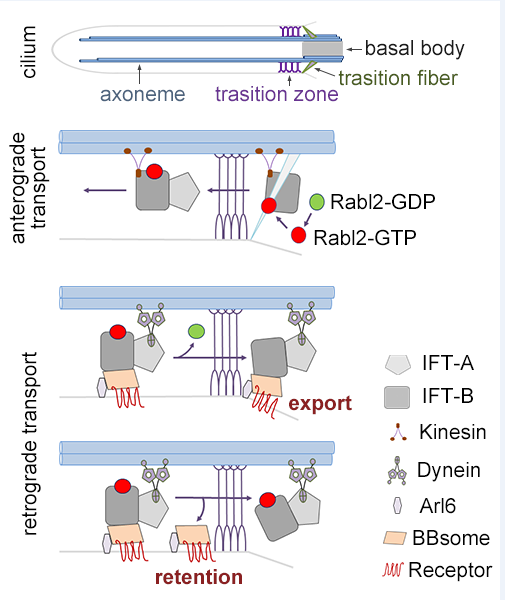
Rabl2调控膜蛋白转运出纤毛的模式图