12月20日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)丁建平研究组在Journal of Molecular Cell Biology发表了题为“Molecular basis for the functions of dominantly active Y35N and inactive D60K Rheb mutants in mTORC1 signaling”的论文,该研究揭示了Rheb疾病相关突变体Y35N和D60K调控mTORC1活性的分子机制。
mTORC1信号通路通过感受和整合外界信息,如生长因子、能量状态和营养水平等,调控多种生命过程。在氨基酸信号的刺激下,一系列蛋白质及复合物共同发挥功能,通过Rag GTPase将mTORC1招募到溶酶体膜上,使其被定位于溶酶体膜上的小G蛋白Rheb结合并激活。与其它小G蛋白类似,Rheb主要依靠结合GTP和GDP状态的循环过程中switch 区域的构象变化、发挥分子开关功能,并通过switch区域与mTOR激酶相互作用进而别构调控mTORC1的活性。Rheb在switch区域的突变直接影响了其对mTORC1信号通路的激活,如近期在多种肿瘤组织中被鉴定出的RhebY35N突变体,能够在细胞饥饿状态下表现出对mTORC1较高的激活作用;而失活型突变体RhebD60K无论在营养充足或饥饿条件下均不能激活mTORC1。但这些突变导致Rheb功能发生变化的分子机制均不清晰。
丁建平研究组长期从事mTORC1信号通路调控的分子机制研究,先后解析了该信号通路中一些重要调控蛋白包括Rheb、S6K1、CASTOR1和Ragulator复合物的晶体结构,揭示了它们在mTORC1信号通路中发挥功能的分子基础。前期工作中他们解析了Rheb-GTP和Rheb-GDP的晶体结构。在此基础上,丁建平研究组的博士生张春笑和张天龙研究员进一步解析了RhebY35N-GppNHp、RhebY35N-GDP和RhebD60K-GDP的晶体结构。结构分析和体外功能实验结果表明,在RhebY35N-GppNHp和RhebY35N-GDP结构中,switch I区域均“模拟”了RhebWT-GTP中的构象,导致RhebY35N无论结合GTP还是GDP均能与mTOR结合并激活mTORC1;而D60K的突变导致RhebD60K只能处于结合GDP的失活状态,并且RhebD60K-GDP结构中switch I区域的构象与RhebWT-GDP中的类似,因此无法激活mTORC1。
该工作揭示了与疾病相关的Rheb突变体调控mTORC1活性的分子机制,有助于阐明mTORC1信号通路功能失调与相关疾病发生发展的关系,为针对这些突变体的药物设计提供了结构基础和理论依据。
该研究得到国家自然科学基金的经费支持。感谢上海同步辐射光源BL17U1线站和国家蛋白质科学研究设施(上海)BL18U和BL19U1线站的工作人员在晶体衍射数据收集中的支持与帮助。
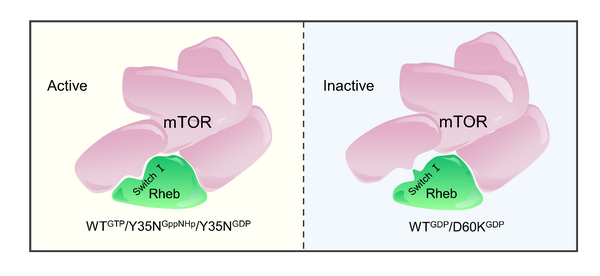
RhebY35N和RhebD60K突变体调控mTORC1活性的分子机制