12月22日,国际学术期刊Cell Discovery在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)丁建平研究组的最新研究成果“Structure and allosteric regulation of human NAD-dependent isocitrate dehydrogenase”。该工作揭示了人源NAD依赖型异柠檬酸脱氢酶(NAD-IDH, IDH3) (α2βγ)2八聚体的组装和变构调控的分子机制。
异柠檬酸脱氢(IDH)负责催化异柠檬酸(ICT)氧化脱羧生成α-酮戊二酸(α-KG),是三羧酸循环中重要限速酶。在人和其他高等真核生物细胞中,存在依赖于NADP和NAD二种辅酶的IDH(NADP-IDH和NAD-IDH)。人源NADP-IDH有二种,分别定位于细胞质和线粒体中(IDH1和IDH2),它们在细胞氧化损伤和脂类合成中发挥重要作用。近期研究表明,IDH1和IDH2在活性反应中心关键氨基酸的突变导致原有酶活的丧失,但产生了一种新的催化功能,与多种肿瘤的发生发展直接相关。人源NAD-IDH(IDH3)定位于线粒体,在三羧酸循环中发挥功能。
丁建平研究组前期对NADP-IDH做了大量的研究工作,相继解析了人源IDH1 (J. Biol. Chem. 2004)、IDH1 R132H突变体 (Cell Res. 2010)和酵母线粒体NADP-IDH (Protein Sci. 2008)的结构,揭示了这些酶发挥催化反应的分子机制。近年来,致力于人源NAD-IDH(IDH3)的结构、功能和调控机制的研究。对人源IDH3的生化研究表明,人源IDH3由α, β和γ三个亚基组成,它们组成αβ和αγ两个异源二聚体,再组装成α2βγ异源四聚体,并进一步组装成八聚体;αγ二聚体和α2βγ四聚体具有类似的酶学性质,都能够受到一系列代谢小分子的异构调控,但αβ二聚体不能被调控;在α2βγ四聚体中,α亚基发挥催化功能,γ亚基发挥调节功能,而β亚基只发挥结构功能(Sci. Rep. 2017a)。进一步的结构和功能研究揭示了αγ二聚体能够被CIT、ADP和低浓度ATP激活、NADH和高浓度ATP抑制,而αβ二聚体不能被代谢小分子激活但能被NADH抑制的分子机制。但到目前,人们对αβ和αγ两个二聚体是如何组装成α2βγ四聚体、并进一步组装成八聚体并发挥协同功能的分子机制还不清楚。
丁建平研究组成功解析了人源IDH3八聚体(α2βγ)2在未结合底物和配体(Apo)、处于非激活状态下的晶体结构。结构和功能分析表明,αγ和αβ通过clasp结构域相互作用形成α2βγ四聚体,两个四聚体再进一步通过γ亚基的N端插入到β亚基的back cleft组装成稳定的八聚体(α2βγ)2。通过这种组装方式,4个催化α亚基处于IDH3八聚体的外侧,有利于底物ICT和辅酶NAD的结合和催化反应的进行。γ亚基通过αγ-αβ相互作用界面的clasp结构域将变构调控信号传递至两个催化亚基。γ亚基的N端与β亚基的相互作用不仅在八聚体的组装中起决定作用,还在四聚体-四聚体相互协同功能中发挥重要作用。该工作不仅阐明了人源IDH3全酶的组装机制和别构调控机制,也为研究其他高等真核生物NAD-IDH的组装和调控机制提供了基础。
丁建平组研究生孙鹏凯为本文的第一作者,丁建平研究员为通讯作者。感谢国家蛋白质科学研究设施(上海)规模化蛋白质制备系统和上海同步辐射光源17U1线站工作人员的帮助。该研究工作得到了国家自然科学基金委、国家科技部和中科院的经费支持。
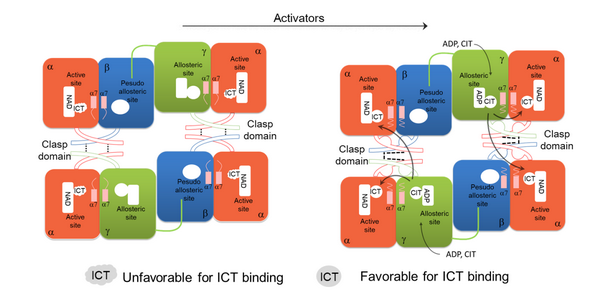
人源IDH3八聚体(α2βγ)2全酶的组装机制和别构调控机制