1月26日,国际学术期刊P NATL ACAD SCI USA在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)丛尧团队与朱学良团队的最新合作研究论文“Distinct architecture and composition of mouse axonemal radial spoke head revealed by cryo-EM”。该研究综合应用冷冻电镜、细胞生物学及生物化学方法,首次解析了鼠源辐射轴头部复合体的3.2 埃分辨率冷冻电镜结构,揭示了高等动物辐射轴复合体在进化过程中的差异,以及辐射轴在纤毛摆动过程中发挥作用的结构机制。
辐射轴(radial spoke,RS)是从轴丝二联微管伸出的由二十多个亚基形成的超大分子复合体。在运动纤毛或鞭毛中,RS头部接触中央微管(central pair,CP)附属结构,将机械信号和化学信号从中央微管传输到轴突动力蛋白臂,从而发挥协调纤毛运动的功能。尽管RS组分在进化中得以保留,但RS头部复合体在原生动物和后生动物之间的形态差异很大。而且,RS头部组分的基因突变与表现为复发性气管炎、不育和内脏倒位等病征的原发性纤毛运动障碍(primary ciliary dyskinesia,PCD)密切关联。先前对RS的研究主要应用冷冻电子断层重构(cryo-ET)技术,分辨率较低,并且主要集中在低等生物。近来原生生物衣藻的RS结构研究取得进展,但至今尚无高分辨率的高等动物RS结构,制约了对纤毛摆动分子机制的理解。
研究人员在小鼠原代培养细胞中检测了RS同源蛋白的纤毛定位情况,结合体外生化实验,发现小鼠RS头部复合体由Rsph1、Rsph3b、Rsph4a及Rsph9亚基组成,但缺少Rsph6a和Rsph10b(其直系同源物存在于原生动物的RS头中),与衣藻中的组成成分有很大差异,并且存在组织特异性表达(图A)。表明在进化过程中,生物为了适应不同条件下的运动环境,产生了有一定差异的RS,进而产生了不同的纤毛摆动方式。
研究人员解析了鼠源RS头部复合体3.2埃分辨率的冷冻电镜结构,并进行了从头建模,此为首个高等动物RS头部复合体的原子结构(图B-C)。该结构呈二重对称的“刹车片”状结构,其中Rsph4a与Rsph9形成紧凑的“身体”,伸展着两个由Rsph1形成的扭曲状的长臂,同时可能通过Rsph3b背侧连接到RS的茎部。发现多种PCD致病性突变发生在可能对该复合体的组装或稳定性至关重要的位点(图D),可能导致辐射轴头部组装异常,进而引起纤毛摆动异常。此外,结合多尺度结构信息的建模分析表明,RS头部既可以通过齿状Rsph4a区域刚性地或通过其伸展的双臂弹性地接触CP的周期性突起(图E),以此优化RS-CP的相互作用和机械信号转导,进而精确控制纤毛的摆动。
该研究首次解析了在高等动物纤毛运动中起关键作用的RS头部复合体的高分辨率冷冻电镜结构,阐明了辐射轴和中央微管附属结构的相互作用方式,为研究纤毛摆动的分子机制提供了重要的结构基础,并揭示了相关基因突变导致PCD的可能病因。
丛尧组博士研究生郑伟,朱学良组博士研究生李凡为本文共同第一作者;分子细胞卓越中心丛尧研究员,朱学良研究员和鄢秀敏研究员为本文共同通讯作者。该研究得到了分子细胞卓越中心鲍岚研究员、李典范研究员和周兆才研究员,清华大学潘俊敏教授的大力支持。该研究获国家科技部、基金委和中科院等的经费支持,并得到国家蛋白质科学研究(上海)设施的冷冻电镜系统、质谱系统、数据库与计算分析系统及蛋白质表达纯化系统的大力支持。
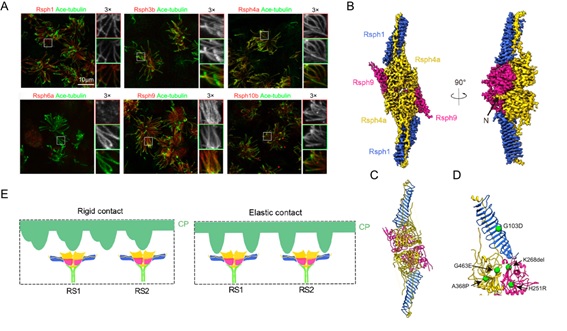
(A)mEPC的免疫荧光显示Rsph1,Rsph3b,Rsph4a,Rsph9和Rsph10b(而不是Rsph6a)位于纤毛轴突中。(B-C)RS头部复合体的3.2埃分辨率冷冻电镜结构及其原子模型。(D)已知引起PCD的突变mapping到原子模型上。绿色球代表与PCD相关的突变。(E)RS头部与中央微管附属结构相互作用的两种可能模式。