2月10日,国际知名学术期刊Cell Stem Cell在线发表了中国科学院分子细胞科学卓越创新中心周斌研究组和上海市胸科医院何奔研究组合作研究论文“A Suite of New Dre-recombinase Drivers Markedly Expands the Ability to Perform Intersectional Genetic Targeting”。该研究系统建立了双同源重组酶介导的谱系示踪及遗传靶向新技术,并利用新技术发现成体脂肪干细胞(PDGFRa+PDGFRb+细胞)。该研究创建的遗传新工具和策略适用于多种组织器官的发育、疾病和再生等研究,为深入了解器官发育,组织稳态和再生过程中细胞起源及命运调控机制提供了更多更强大的遗传工具。
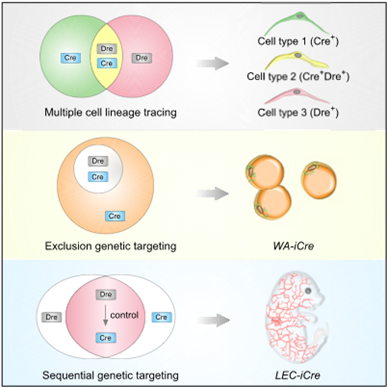
阐明器官发育与组织再生中细胞起源和命运调控机制对深入了解体内细胞命运可塑性具有重要意义。Cre-loxP等同源重组酶介导的遗传谱系示踪及遗传靶向操作技术是揭示体内细胞生物学功能的重要工具,不仅可以用于深入研究器官发育和再生过程中的分子机制,也是追踪体内细胞起源和命运调控的重要手段。该技术能否精确进行遗传操作的关键在于驱动Cre表达的基因/启动子是否特异,目前部分研究中使用的驱动Cre表达的基因/启动子并不特异,容易造成实验结果的假阳性,以致于在细胞命运和基因功能分析等研究中出现诸多争议。在以往的研究中,周斌研究组开发了基于Dre-rox与Cre-loxP双同源重组酶系统的遗传谱系示踪新技术,并利用该技术解决了心血管领域中有关成体心脏干细胞的重大科学争议。在该研究中,他们构建了多种基于Cre-loxP和Dre-rox双同源重组酶系统的遗传工具小鼠,设计了多种遗传示踪和靶向操作的新策略,不仅实现了更为精准地遗传谱系示踪和遗传靶向操作,还极大地拓宽了遗传示踪和靶向操作技术使用范围。利用新的遗传工具和策略,他们首先对脂肪组织进行了深入系统的研究,发现了成体脂肪干细胞。
近年来,全球肥胖人数日益增多,肥胖已成为世界性的公共卫生问题,它给人类带来的影响不仅是外貌体态的改变,更重要的是肥胖所引起的一系列疾病,如高血压、心脑血管疾病、糖尿病乃至恶性肿瘤等,严重威胁人们的健康。脂肪细胞数量增加和体积增大是肥胖最主要的特征。哺乳动物的脂肪细胞主要分为两种:一种是储存脂质的白色脂肪细胞,它包含一个占据大部分细胞体积的单个大脂质囊泡和少量的线粒体;另一种是燃烧脂质产生热量的褐色脂肪细胞,细胞内含有一些分散的小脂滴和大量的线粒体。肥胖主要是由于白色脂肪细胞的大量堆积,目前,在成体组织稳态和应激条件下,新生白色脂肪细胞的来源并不完全清楚。
近十年来有大量研究结果表明,成体白色脂肪细胞的生成是在脂肪组织的血管壁附近进行的。血管壁从内到外主要由三层细胞构成:血管内皮细胞、血管壁细胞(包括周细胞和平滑肌细胞)和成纤维细胞。2008年,Jonathan M. Graff研究组在Science报道了脂肪干细胞主要来源于血管壁上的周细胞,并利用谱系示踪技术发现PDGFRb+血管周细胞可以在正常生理条件下产生新的脂肪细胞。随后,Rana K. Gupta研究组证实了PDGFRb+的血管周细胞可以在应激条件下转分化为脂肪细胞。然而,在2017年,Sylvia M. Evans研究组利用基于Tbx18的遗传工具对血管周细胞做了更为详尽的细胞谱系示踪工作,他们的研究结果否定了血管周细胞是脂肪干细胞的结论。为解决以上科学争议,周斌研究组和何奔研究组合作创建了多种新的Dre和Cre工具小鼠,并结合Cre-loxP和Dre-rox双同源重组酶系统,对脂肪组织中PDGFRb+的细胞和PDGFRa+的细胞进行遗传谱系示踪,结果发现了一个既表达PDGFRa又表达PDGFRb的细胞亚群。利用双同源重组的谱系示踪技术,他们实现了将PDGFRa单阳性细胞、PDGFRb单阳性细胞和PDGFRa/PDGFRb双阳性细胞在一个小鼠体内同时进行特异性标记。在冷刺激环境下,发现只有PDGFRa单阳性细胞和PDGFRa/PDGFRb双阳性细胞才会转分化形成脂肪细胞,并揭示PDGFRa/PDGFRb双阳性细胞群具有更强的产生新脂肪细胞的能力,该研究首次发现了PDGFRa/PDGFRb双阳性细胞是成体脂肪干细胞。进一步对小鼠脂肪组织进行单细胞转录组测序发现,PDGFRa单阳性细胞亚群和PDGFRa/PDGFRb双阳性细胞亚群在基因表达水平上是具有显著差异的。PDGFRa/PDGFRb双阳性细胞亚群会高表达Cxcl14, Steap4和Col15a1等基因,而PDGFRa单阳性细胞亚群则高表达Pi16, Sbsn和Dpp4等基因。同时发现PDGFRa/PDGFRb双阳性细胞亚群中的上调基因与细胞外组织结构、血管发育、对伤口的应激以及脂肪细胞分化等信号调控等相关。
迄今为止,由于遗传工具小鼠的局限性,缺乏特异性靶向白色脂肪细胞和特异性靶向淋巴管内皮细胞的遗传工具。现有的脂肪细胞Cre工具小鼠会同时靶向白色脂肪细胞和褐色脂肪细胞,而现有的淋巴管内皮细胞Cre的工具小鼠,例如Prox1-Cre在靶向淋巴管内皮细胞的同时也会靶向心肌细胞、肝细胞和神经细胞等其它类型细胞。周斌研究组和何奔研究组在该项研究中创建了更精确的基因靶向策略,通过利用双同源重组的交叉遗传学设计了“NOT”和“AND” 两种遗传策略,能实现更精准的谱系示踪和遗传靶向操作,用于体内基因功能的研究。利用“NOT”策略,他们创建了白色脂肪细胞的特异性靶向工具;利用“AND”策略,他们创建了淋巴管内皮细胞特异性的遗传靶向工具。“NOT”逻辑策略类比于数学集合中的取补集过程,即把所有的脂肪细胞看作集合S,褐色脂肪细胞群为S的一个子集A, 白色脂肪细胞群就是取子集A在S中的补集。“AND”的逻辑学策略类比于数学集合中的取交集过程,即把内皮细胞群(血管内皮细胞、淋巴管内皮细胞等)类比于集合A,PROX1标记的所有细胞(淋巴管内皮细胞,神经细胞,心肌细胞,肝细胞,晶状体上皮细胞和纤维细胞等)类比于集合B,淋巴管内皮细胞就是取A和B的交集。
综上,该项研究建立和推广了双同源重组酶介导的遗传谱系示踪和遗传靶向操作新技术,建立了多种遗传示踪和靶向操作的新策略,为多种组织器官的发育、疾病、再生等研究提供了强大的技术基础。该研究着重研究了成体脂肪组织中新生脂肪细胞的来源,通过对脂肪组织血管周围多种不同细胞亚群同时进行遗传示踪,发现了成体脂肪干细胞,为进一步研究肥胖及肥胖相关的慢性疾病提供了新方向。为拓展双同源重组遗传谱系示踪技术的应用,该研究分别介绍了“NOT”(比如白色脂肪特异性靶向工具)与“AND”(比如淋巴管内皮细胞特异性靶向工具)的应用,为进一步研究白色脂肪细胞与淋巴管内皮细胞的功能调控机制研究提供了更精准的遗传靶向操作工具。
周斌研究组博士研究生韩溪檬、张震芊、朱欢以及副研究员何灵娟(现西湖大学研究员)为该论文共同第一作者。分子细胞卓越中心周斌研究员和上海市胸科医院何奔教授为该论文共同通讯作者。该研究得到了暨南大学田雪莹研究员,复旦大学附属中山医院王利新教授,上海交通大学附属第九人民医院段胜仲教授,上海南方模式生物研究中心费俭教授、孙瑞林博士、王津津博士,瑞典阿斯利康公司Qing-Dong Wang博士以及中科院分子细胞卓越中心动物平台和细胞平台的大力支持,并得到来自中科院、基金委、科技部、上海市科委等部门的经费支持。