2月8日,国际学术期刊Nature Communications在线发表了中国科学院分子细胞科学卓越创新中心高栋研究组和复旦大学陆路教授、孙艺华教授、谢幼华教授合作研究论文“Distinct mechanisms for TMPRSS2 expression explain organ-specific inhibition of SARS-CoV-2 infection by enzalutamide”。研究工作解析了性激素信号通路与新冠病毒感染药物敏感性和器官特异性的分子机制。
新型冠状病毒(SARS-CoV-2)的爆发导致了全球范围的新冠病毒疫情大流行。前期的流行病学统计显示男性的感染率和死亡率明显高于女性,因此快速地寻找和开发抗病毒的药物,并解析性别差异导致的易感性和致死性差异的分子机制,成为了亟待解决的重要问题。
体外的细胞实验表明,丝氨酸蛋白酶TMPRSS2可以通过切割新冠病毒的刺突蛋白进而促进病毒入侵宿主细胞。在前列腺癌细胞中TMPRSS2的表达受到雄激素受体(AR)介导的信号通路调控,因此靶向抑制雄激素信号通路或者直接抑制TMPRSS2的活性都是潜在治疗新冠病毒感染的重要研究方向。AR的靶向抑制剂恩杂鲁胺可以抑制前列腺细胞中TMPRSS2的表达,而且恩杂鲁胺已经应用于临床上治疗前列腺肿瘤患者,其具有安全性和药物代谢动力学特征明确等优点。但是,恩杂鲁胺是否抑制TMPRSS2的表达进而发挥抑制新冠病毒的疗效仍然不明。
为了探究以上问题,研究人员构建了用于新冠病毒感染的多种小鼠模型、人源肺组织类器官、前列腺类器官等研究体系,并结合病理学、分子细胞生物学和生物信息学的技术手段,发现Tmprss2敲除小鼠肺部的病毒载量和病理损伤显著少于野生型小鼠,并未表现出明显的体重下降,在动物水平证实了TMPRSS2在介导新冠病毒入侵宿主细胞的重要作用。进一步利用多种细胞系、人源正常肺组织的类器官和小鼠模型,研究人员证实了虽然在前列腺细胞中,恩杂鲁胺能够通过下调TMPRSS2表达水平进而抑制新冠病毒的入侵,但是在肺的细胞中恩杂鲁胺并不能调控TMPRSS2的表达,不具有抑制新冠病毒的疗效。
为了进一步揭示恩杂鲁胺在不同器官中疗效差异的具体机制,研究人员利用ChIP-seq和ATAC-seq发现AR的信号通路活性具有器官特异性,在前列腺细胞中AR介导的信号通路可以调控TMPRSS2的表达,而在肺细胞中TMPRSS2的表达不受到AR介导的信号通路调控。通过分析43例正常肺组织的基因表达水平,研究人员也进一步证实了TMPRSS2和AR的表达水平并不具有显著相关性,为恩杂鲁胺不能抑制新冠病毒肺部感染提供了完整的分子机理。此外,通过分析雌激素相关的信号通路,研究人员进一步证实雌激素在肺中也不能调控TMPRSS2的表达,为雌激素相关的治疗手段提供了一定的理论基础。
该工作首次利用基因编辑小鼠证实了TMPRSS2在介导新冠病毒入侵宿主细胞中的重要作用,并且表明雄激素受体AR的活性具有器官特异性,因此AR的抑制剂恩杂鲁胺并不能调控肺细胞中TMPRSS2的表达,不具有治疗新冠病毒肺部感染的疗效。此外,该工作揭示了研究激素受体器官特异性功能的重要性,并且为治疗包括具有激素敏感性的传染病和肿瘤在内的疾病提供了一定的理论基础。
分子细胞卓越中心高栋研究员为该论文的通讯作者,复旦大学陆路,孙艺华和谢幼华教授为共同通讯作者,分子细胞卓越中心博士生李飞、韩铭、戴鹏飞、何娟以及复旦大学徐巍、陶晓婷和吴杨为本文共同第一作者。该研究得到了分子细胞卓越中心季红斌研究员,复旦大学王乔和姜世勃教授的大力支持。该工作得到中国科学院、国家自然科学基金委、科技部等经费支持。
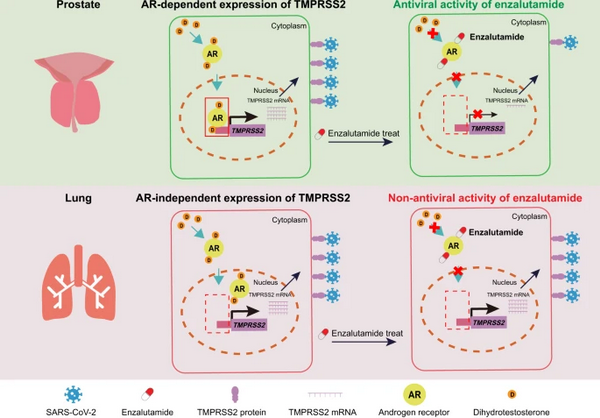
雄激素信号通路与新冠病毒感染药物敏感性和器官特异性的分子机制