5月9日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)鲍岚研究组在国际学术期刊Journal of Molecular Cell Biology发表了题为“SUMOylation of α-tubulin is a novel modification regulating microtubule dynamics”的研究成果。该研究发现,SUMO化修饰是α-微管蛋白上的一种新型翻译后修饰,在微管动态性调节中具有重要作用。
翻译后修饰是微管动态性调节的重要因素。迄今,微管蛋白上已经发现了多种翻译后修饰,包括乙酰化、甲基化、脱酪氨酸化、谷氨酰化等。近年来,微管蛋白上新型翻译后修饰的发现和鉴定也颇受关注。已有研究表明,SUMO化修饰在微丝和中间纤维等骨架上存在,并且调节其动态性。然而,微管蛋白上的SUMO化修饰及其对微管动态性的调节作用尚不清楚。
在该工作中,研究人员首先通过细胞和体外实验确定了微管细胞骨架的基本组成单位α-tubulin能够被SUMO1分子共价修饰。进一步研究表明,该修饰主要发生于游离状态的α-tubulin上;作为一种可逆的翻译后修饰,该修饰的去除主要由蛋白酶SENP1完成;一系列体外实验证实,α-tubulin的SUMO化修饰能够降低微管原纤维之间的侧向作用力,促进微管坍塌发生,抑制微管的聚合。结合生物信息预测和定点突变等手段,研究发现SUMO1主要在96、166和304位赖氨酸上发生,α-tubulin的SUMO化缺陷突变导致游离和聚合状态的微管蛋白比例失调。综上所述,该工作鉴定了SUMO化作为α-tubulin上的新型翻译后修饰,对微管动态性具有重要的调节作用。
中科院分子细胞卓越中心鲍岚研究员为通讯作者,冯文峰和刘荣博士为该论文共同第一作者。该研究得到了上海交通大学李勇教授和程金科教授、中科院脑智卓越创新中心张旭研究员的大力支持。该工作得到了国家自然科学基金委、中国科学院战略先导和上海市科委的经费资助。
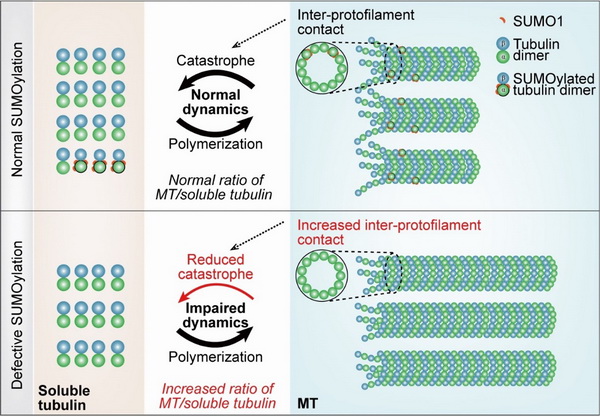
α-tubulin的SUMO化修饰对微管动态性的调控