5月17日,国际学术期刊Nature Communications在线发表了中国科学院分子细胞科学卓越创新中心周斌研究组最新研究进展“Genetic fate-mapping reveals surface accumulation but not deep organ invasion of pleural and peritoneal cavity macrophages following injury”。该研究开发了基于Dre-rox与Cre-loxP双同源重组酶系统的遗传谱系新技术,构建了可以高效特异标记体腔巨噬细胞的工具小鼠(CD45-Dre;Gata6-iCreER;R26-tdTomato)。同时揭示了在肝脏和肺脏受到损伤的情况下,体腔巨噬细胞聚集在损伤表面而不能渗透进实质细胞中参与损伤修复。该研究为深入清晰认识体腔巨噬细胞的功能提供了强有力的遗传学工具。
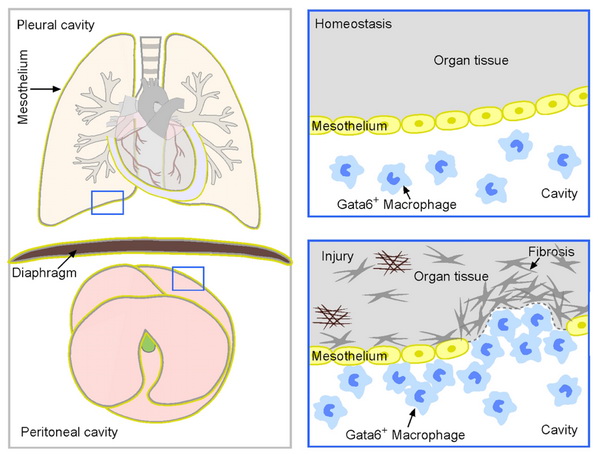
巨噬细胞广泛分布于各个组织和器官中,在免疫应答、组织修复和再生等方面具有重要意义。在脊椎动物发育中,存在着各种体腔,包括包围着肝、肠、胃、脾等内脏器官的腹腔,肺脏所在的胸腔以及心脏所在的心包腔。近几年研究发现在这些体腔中存在着一类特殊的巨噬细胞,它们在清除体内有害物质和微生物以及清除死亡组织中发挥着关键性的作用。心脏是人体最为重要的器官,由于其再生和损伤修复的能力极低,一旦发生损伤,心脏功能便会受到不可逆的影响。因此心脏损伤后修复过程一直吸引广大的科研工作者进行研究。此前加拿大卡尔加里大学的研究人员发现,位于心包腔中的一群GATA6+心包腔巨噬细胞具有心脏修复的功能,它们可以迁移进实质细胞参与小鼠心脏损伤后的修复。早在2016年,他们就发现在肝脏受到损伤的情况下,腹腔中的巨噬细胞会快速附着到损伤区域参与肝脏损伤修复。探索巨噬细胞功能的多样性及其在病理生理过程中的功能将为人们提供许多人类疾病治疗的新靶点和新思路,具有重要的临床指导意义。
以往的研究主要是利用Ccr2-tdTomato, Cx3cr1-GFP, LysM-eGFP和Gata6H2B-Venus等单基因荧光报告小鼠结合体外移植实验标记示踪Gata6+巨噬细胞,缺乏对体腔巨噬细胞的直接精准标记和遗传谱系示踪。由于单基因示踪系统的局限性和不特异性,之前的研究结果缺少令人信服的遗传学证据,关于体腔巨噬细胞的功能存在较大争议。因此,建立一种特异性遗传示踪工具小鼠体内标记这群细胞并阐明其功能显得尤为重要。
虽然体腔巨噬细胞高表达转录因子GATA6,可以将它与组织驻留型巨噬细胞和单核细胞区分开来,但是GATA6同时表达在多种器官的实质细胞中,比如肝细胞、心肌细胞、肺上皮细胞等等,这使得GATA6不能被单独用于示踪体腔巨噬细胞。为了特异性在小鼠体内示踪体腔巨噬细胞,周斌研究组建立了一种基于Dre-rox和Cre-loxP双同源重组酶介导的新型遗传谱系示踪系统。研究人员同时构建了造血细胞特异性标记的CD45-Dre小鼠和受Gata6启动的CreER小鼠。在这套系统中CD45+的细胞表达Dre重组酶,与rox位点发生同源重组,去除Gata6-rox-stop-rox-CreER(Gata6-iCreER)中间的stop位点,在CD45+的细胞中将Gata6-iCreER转变成Gata6-CreER小鼠。同时小鼠经Tamoxifen诱导后,在表达CD45的基础上又表达GATA6的细胞中,Cre由细胞质进入细胞核,识别报告基因R26-tdTomato上的loxP位点发生Cre-loxP介导的同源重组从而使CD45+Gata6+双阳性的细胞被标记上红色荧光蛋白(tdTomato)。CD45可以区分巨噬细胞(CD45+)和器官实质细胞(CD45–),同时GATA6 可以区分体腔巨噬细胞(Gata6+)和组织驻留型巨噬细胞(Gata6–)或单核细胞(Gata6–)。不同于以往依赖单一分子结合体外移植标记追踪某一群细胞的研究模式,他们则是通过双同源重组系统将巨噬细胞亚群-体腔巨噬细胞不可逆的标记上红色荧光蛋白。不仅如此,为了能够使该系统适用于基因敲除或过表达等遗传学操作,周斌研究组采用了顺序相交的遗传学方法,即Dre介导的CreER激活可以靶向任何loxP位点,用于基因功能的研究。研究人员首先建立了严格的验证系统,设置多种对照验证该系统标记的效率和特异性。实验结果表明CD45-Dre;Gata6-iCreER;R26-tdTomato小鼠能够高效特异地标记胸腔和腹腔中的巨噬细胞,既不会异位标记血液中的免疫细胞,在没有他莫昔芬的诱导下也不会标记任何细胞。该系统的建立为特异性标记巨噬细胞亚群研究其在在器官损伤修复再生中的的命运转变及功能奠定了坚实可靠的基础。
接下来为了研究Gata6+巨噬细胞对器官损伤修复的作用,研究人员首先对CD45-Dre;Gata6-iCreER;R26-tdTomato小鼠给予他莫昔芬诱导标记Gata6+巨噬细胞。静置一周后构建多种肝脏损伤模型,包括外部机械性导致的热损伤(heat injury, HI)和低温损伤(cryoinjury, CI),内部药物诱导的急性四氯化碳损伤(acute CCl4 injury)、慢性四氯化碳损伤(chronic CCl4 injury)和对乙酰氨基酚损伤(acetamonophen, APAP)。免疫荧光染色和流式实验结果表明在药物诱导的肝内部损伤模型中几乎没有发现tdTomato阳性的细胞。在机械性导致的肝外部损伤模型中,tdTomato阳性的细胞主要聚集在损伤区域的表面,并伴有增厚的间皮层。体内遗传学证据表明在这些非遗传操作的损伤模型中tdTomato阳性的腹腔巨噬细胞主要聚集在损伤肝脏表面,很少通过损伤位点深入肝脏内部。此外,利用Ms4a3-CreER工具小鼠示踪循环中的单核细胞以及免疫染色肝枯否细胞(Kupffer cell)标志基因CLEC4F表明在肝脏CCl4损伤模型中,肝组织中GATA6+tdToamto–的细胞主要是驻留型肝枯否细胞,而不是循环中单核细胞贡献的巨噬细胞。
为了进一步探讨GATA6+巨噬细胞是否参与其他脏器损伤后的修复再生,研究人员对肺脏构建了不同的损伤模型。在示踪胸腔巨噬细胞的同时,观察其是否可以迁移进肺实质组织参与损伤后的修复和再生。同样地,在给予CD45-Dre;Gata6-iCreER;R26-tdTomato小鼠他莫昔芬诱导标记Gata6+巨噬细胞静置一周后,构建多种肺脏损伤模型,包括博莱霉素损伤(Bleomycin)、脂多糖损伤(lipopolysaccharide, LPS)和低温损伤(cryoinjury, CI)。实验结果表明在药物诱导的肺泡Bleomycin和LPS损伤中在肺内部很少检测到tdTomato阳性细胞。在低温造成的损伤区域中可以发现聚集了大量tdTomato阳性细胞,但这些细胞并没有深入进入肺内部。研究人员利用这个高效特异示踪体腔巨噬细胞的系统再次证明,胸腔巨噬细胞主要聚集肺脏表面,而不深入肺脏内部参与器官修复。
综上,该研究的亮点在于开发了一种双同源重组酶介导的谱系示踪新技术来特异性标记巨噬细胞亚群-体腔巨噬细胞。该系统突破了传统的思维模式和技术局限性,可以不依赖于体外移植实验,在小鼠体内直接标记体腔巨噬细胞研究其细胞运动与功能。不同于以往的技术手段和方法,全新构建的遗传谱系示踪技术可以深入精准的标记体腔巨噬细胞,在小鼠体内得到更为精确的实验结果。这不仅为炎症细胞募集提供了新的研究模型,为巨噬细胞生物学和再生医学提供了一个全新的领域,也为治疗器官炎症和促进组织修复提供了潜在的治疗策略,具有重要的战略意义。
分子细胞卓越中心周斌研究组博士后金恒薇、博士后刘扩和副研究员唐娟为该论文共同第一作者,周斌研究员为该论文通讯作者。该研究得到了德国勃林格殷格翰公司、新加坡免疫所Florent Ginhoux教授、南京医科大学季勇教授、上海市胸科医院何奔教授、复旦大学附属中山医院王利新教授及国家蛋白质中心(上海)、分子细胞卓越中心动物平台和细胞平台的大力支持,并得到来自中科院、基金委、科技部、上海市科委等部门的经费支持。
文章链接:https://www.nature.com/articles/s41467-021-23197-7