7月15日,国际学术期刊Nucleic Acids Research在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周小龙研究组最新研究成果“Mutually exclusive substrate selection strategy by human m3C RNA transferases METTL2A and METTL6”。
在细胞内所有RNA分子中,tRNA含有最为密集且种类最为多样的转录后修。tRNA修饰常位于环状区域,不同修饰具有不同的生物学功能,包括维持tRNA结构的稳定、保证密码子-反密码子配对的精确性、促进mRNA翻译的保真性和效率等,从而精准调节基因表达和蛋白质稳态。3-甲基胞嘧啶(m3C)修饰广泛存在于真核生物细胞质tRNAThr、tRNASer、哺乳动物细胞质tRNAArg(CCU)、tRNAArg(UCU)以及线粒体tRNAThr和tRNASer(UCN)的反密码子环的第32位(m3C32)。此外,m3C还存在于哺乳动物细胞质延伸tRNAMet第20位(m3C20)及tRNASer、tRNALeu第47d位(m3C47d)。目前仅鉴定出m3C32甲基转移酶,m3C20及m3C47d甲基转移酶尚未被鉴定。在酿酒酵母中,m3C32由单一的甲基转移酶Trm140修饰;在裂殖酵母中,由Trm140和Trm141两种酶负责,而人细胞中则有三种酶(METTL2A、METTL2B和METTL6)参与了胞质tRNA的m3C32修饰。METTL2A与METTL2B基因组成、蛋白质序列几乎完全相同,仅有6个氨基酸的差异。已有报道表明,非酶辅助因子DALRD3基因参与的tRNAArg m3C32修饰缺陷导致发育迟缓和癫痫性脑病。但所有m3C32甲基转移酶的修饰活力尚未被重组;多种m3C32修饰酶的底物识别与选择性机制、非酶辅助因子在修饰中的作用、m3C32修饰的生物学功能及修饰缺陷导致疾病的分子机制等一系列科学问题都完全未知。
该研究中,研究人员纯化获得了高纯度的METTTL2A、METTTL2B和METTTL6,首次成功重组了METT2A对tRNAThr的m3C32修饰活性;在丝氨酰-tRNA合成酶(SerRS)的辅助下,成功重组METTL6对tRNASer(GCU)的m3C32修饰活性;发现METTL2A和METTTL2B在体内均有表达,而METTTL2B的体外修饰活力只有METTTL2A的十分之一;进一步体外生化分析发现,G35和第37位t6A修饰(t6A37)是tRNAThr形成m3C32修饰的必要但不充分条件,而tRNASer(GCU)的反密码子环和长可变环都是其m3C32修饰发生的关键因素,可能分别被METTL6和SerRS协同识别。根据系列实验结果,研究人员提出METTL2A和METTL6底物互斥识别模型,详细阐释了不同m3C32甲基转移酶对不同tRNA的精确性底物识别机制。
该研究首次成功重组人细胞质tRNA m3C32甲基转移酶 METTL2A和METTL6的甲基化修饰活力;阐释了tRNAThr及tRNASer(GCU) m3C32修饰的分子机制;阐明METTL2A和METTL6的底物选择性机制,提出底物选择性互斥识别模型。该研究为进一步阐明m3C32修饰的生物学功能及其导致疾病的分子机制、鉴定胞内其他m3C修饰酶提供了重要的基础。
分子细胞科学卓越创新中心博士研究生毛雪玲为本文第一作者,周小龙研究员为本文通讯作者。分子细胞科学卓越创新中心李青润博士,上海交通大学许泓教授和汪锡金教授参与了该研究;感谢分子细胞科学卓越创新中心王恩多研究员、周金秋研究员及许路昂博士对工作的支持。该工作得到了国家自然科学基金委与中科院的经费资助。
文章链接:
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkab603/6322327
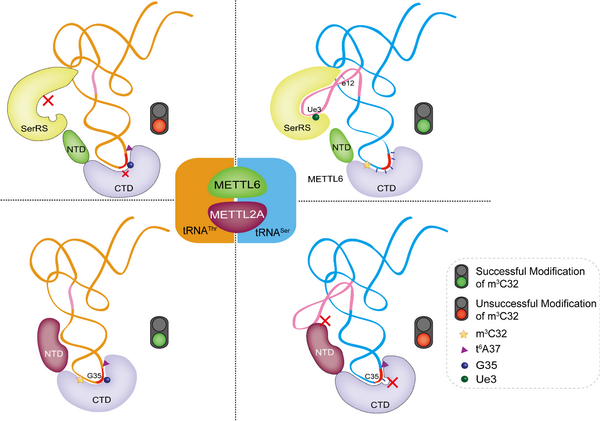
METTL2A和METTL6底物互斥识别模型