9月28日,国际学术期刊Cell Discovery在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周斌研究组的最新研究成果“Sca1 marks a reserve endothelial progenitor population that preferentially expand after injury”。该研究发现Sca1+血管内皮祖细胞在疾病状态下形成更多血管内皮细胞的潜能,明确了Sca1+内皮祖细胞在心血管疾病模型中的作用,为临床应用研究提供了重要的理论基础。
血管结构和功能的改变会引起血管壁弹性下降、管腔狭窄等病理改变,从而引起冠心病、高血压等心血管疾病。血管内皮细胞是构成血管壁组织及维持血管张力的重要细胞成分,它的正常更新对维持组织稳态和损伤修复具有重要意义。因此揭示血管内皮细胞的异质性可以为血管疾病的预防和靶向治疗提供重要的理论基础。前期相关研究表明,Sca1+心脏干细胞不能转分化成心肌细胞,而Sca1+PDGFRa+的血管干细胞在严重损伤模型下可以转分化为血管平滑肌细胞。体外细胞和移植实验表明Sca1+作为血管干细胞可以通过增殖、分化转变为血管内皮细胞,但缺乏体内的直接证据。因此,Sca1+内皮祖细胞是否能贡献到新生内皮细胞有待于进一步研究。
为了系统地研究成体Sca1+内皮祖细胞在正常生理和损伤情况下的命运变化,研究人员建立了特异性标记Sca1+血管内皮细胞的谱系示踪系统,抗雌激素药物他莫昔芬(tamoxifen)诱导处理后,检测发现Sca1-2A-CreER;R26-GFP小鼠可以特异地标记部分血管内皮细胞。利用这个特异性的小鼠,研究人员分别在生理情况、心脏主动脉狭窄诱导纤维化以及股动脉损伤模型下检测了Sca1+内皮祖细胞的分化潜能。通过对8周Sca1-2A-CreER;R26-GFP小鼠注射tamoxifen,收集注射后12-16周小鼠心脏样本,检测发现稳态心脏中,Sca1+内皮细胞比率并未发生变化,说明在稳态情况下Sca1+内皮祖细胞与Sca1–内皮细胞有着一样的增殖效率。进一步实验中,研究人员在tamoxifen诱导的Sca1-2A-CreER;R26-GFP小鼠中分别构建了主动脉缩窄诱导纤维化和股动脉损伤模型,发现相对与Sca1–内皮细胞,Sca1+内皮祖细胞可以贡献更多血管内皮细胞。以上结果说明,成体Sca1+内皮祖细胞在损伤应激的情况下具有更强的增殖能力并形成更多的血管内皮细胞的潜能,从而通过血管新生促进组织的损伤修复。
分子细胞卓越中心周斌研究组副研究员唐娟博士(现同济大学研究员)以及博士生朱欢为该论文共同第一作者,周斌研究员为通讯作者。该研究得到了复旦大学附属中山医院颜彦教授和王利新教授及分子细胞卓越中心动物平台和细胞平台的大力支持。感谢上海南方模式生物中心的帮助,感谢来自中科院、基金委、科技部、上海市科委等部门的经费支持。
文章链接:https://www.nature.com/articles/s41421-021-00303-z
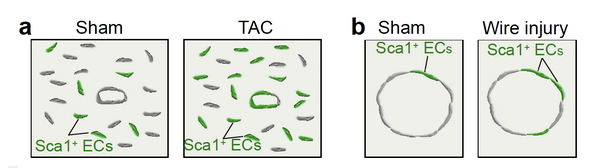
图示:Sca1+内皮祖细胞在主动脉狭窄诱导纤维化模型(a)以及股动脉损伤模型(b)中能分化为内皮细胞.