11月30日,国际学术期刊Nature Communications在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)朱学良研究组的最新研究成果“Cilia locally synthesize proteins to sustain their ultrastructure and functions”。在该研究工作中,研究人员首次揭示运动纤毛中存在信使RNA(mRNA)引导的蛋白质合成,发现其对纤毛自稳态维持的重要性,颠覆了胞体是纤毛蛋白质组唯一来源的固有观点。
通常蛋白质都是在细胞质中合成以后再到特定位置发挥功能,而区域性翻译(local translation)是指特定种类的mRNA被运送到亚细胞结构后再根据需求翻译出蛋白质的特殊表达方式。这种在现场的即时翻译有利于局部区域蛋白质组的稳态维持和快速重塑,实现细胞和个体对亚细胞结构与功能的精确调节。目前已知区域性翻译参与了诸如细胞迁移、胚胎发育、轴突导向、神经可塑性调节,甚至长时程记忆的形成等多个层面的生理活动。
运动纤毛是突出于细胞表面,兼具运动与感知功能的毛状细胞器,可多至每个细胞数百根。运动纤毛在进化上首先出现于原生动物,在高等动物中也广泛存在,其结构复杂、精美而且功能重要。如大脑脑室管膜上皮组织的运动纤毛负责驱动脑脊液的流动,维持中枢神经系统的稳态;气管内的运动纤毛保持呼吸道的湿润与清洁;附睾和输卵管的运动纤毛分别推动生殖细胞进入附睾和子宫等。运动纤毛的缺陷可导致不孕不育、呼吸道感染、脑积水、脊柱弯曲等原发性纤毛运动障碍症(primary ciliary dyskinesia)。纤毛基部具有被称为转接区(transition zone)的扩散屏障,使纤毛内环境与胞体相对隔离,成为较为独立的亚细胞结构。同时,纤毛通过一套特殊的鞭毛内运输(intraflagellar transport,IFT)系统,将很多组分跨越转接区运进或运出纤毛。通常认为,纤毛内的蛋白质均是在细胞体中合成的,然后通过自由扩散或IFT进入纤毛行使功能。
研究人员注意到运动纤毛的质谱分析结果中常存在丰富的蛋白质翻译机器的组分,并在小鼠脑室管膜运动纤毛中观察到核糖体蛋白质、核糖体RNA、翻译起始因子和微管蛋白mRNA。通过嘌呤霉素的代谢性标记结合邻位连接分析(proximity ligation assay)技术,证明无论在原位的多纤毛和分离出的单根纤毛中均存在活跃的包括微管蛋白在内的多肽合成。脆性X智力障碍蛋白(Fragile X mental retardation protein, FMRP)是神经可塑性的重要调节因子,可通过形成RNA颗粒运载神经突内区域性翻译所需的mRNA而发挥功能。研究人员在运动纤毛内也鉴定到FMRP,并发现它在纤毛中央腔呈现类似RNA颗粒的点状分布。FMRP的缺失会导致纤毛内蛋白质翻译活性的下降,虽然不影响纤毛发生,却削弱运动纤毛维持其自稳态的能力,促进其退行性解聚现象的发生。因此,区域性翻译是运动纤毛蛋白质组的另一个来源,它可能为纤毛持续快速摆动导致的机械性损伤提供修复所需的蛋白质组分,从而帮助维持纤毛的结构与功能。由于FMRP的突变是引起包括自闭症在内的智力障碍的重要因素,这些发现也暗示相应突变引起的运动纤毛异常有可能促进了脆性X综合征的病理进程。
分子细胞卓越中心朱学良研究员和鄢秀敏研究员(现为上海交通大学医学院附属新华医院环境与儿童健康重点实验室研究员)为论文通讯作者,博士研究生郝楷为第一作者。该研究得到国家自然科学基金委、科技部和中国科学院的资助,以及中心细胞分析技术平台、分子生物学技术平台和国家蛋白质设施等的技术支持。
文章链接:https://www.nature.com/articles/s41467-021-27298-1
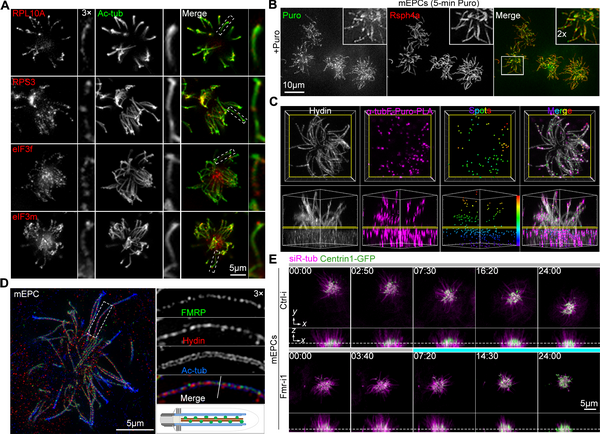
(A)核糖体大小亚基蛋白(RPL和RPS)与翻译起始因子eIF3复合物组分定位于原代培养的脑室管膜运动纤毛中;(B)嘌呤霉素(Puro)脉冲标记检测到运动纤毛内原位合成的新生多肽链;(C)利用邻位连接分析技术检测到纤毛内原位翻译的α微管蛋白;(D)FMRP以点状沿纤毛中央腔分布;(E)时间序列图像显示FMRP缺失的纤毛发生退行性解聚的过程。