1月28日,国际学术期刊Journal of Molecular Cell Biology (JMCB)在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)葛高翔研究组的最新成果“Basement membrane promotes tumor development by attenuating T cell activation”。该研究揭示了肿瘤微环境中基底膜蛋白Laminin等抑制T细胞活化的新功能,阐释了基底膜蛋白组分如何发挥其肿瘤免疫抑制功能。
在肿瘤微环境中,肿瘤细胞可以通过多种机制逃避免疫系统的监视和清除作用。其中,肿瘤中细胞外基质蛋白的表达谱显著区别于正常组织,细胞外基质的异常沉积及其引起的组织硬化是多种实体肿瘤的普遍物理特征,并往往与治疗的抵抗密切相关,是影响肿瘤发展和预后的关键性因素之一。
前人的研究结果表明,细胞外基质既可以通过调节T细胞的迁移、黏附而影响其空间组织定位,又可以通过受体调节其DNA合成和增殖。然而,细胞外基质是否可以直接调节T细胞的活化和功能进而调控抗肿瘤免疫反应尚未可知。
该研究中,作者利用生物信息学的方法对TCGA数据库进行挖掘分析,发现在多个肿瘤类型中基底膜特征性表达谱与杀伤性CD8+ T细胞免疫反应及I型抗肿瘤免疫反应之间具有显著的负相关性关系,而与抑制肿瘤免疫应答的II型免疫反应之间具有显著的正相关性关系。进一步的体内体外实验发现,基底膜组分通过调控T细胞的功能,促进免疫健全小鼠中肿瘤的发生和发展。基底膜组分并不调节T细胞的趋化和招募,而是直接调控了T细胞的活化。基底膜的主要成分有IV型胶原蛋白、Laminin和Nidogen等。利用T细胞体外活化实验体系,作者分析发现基底膜中的Laminin蛋白通过抑制TCR信号,直接抑制T细胞的活化和增殖,并促进T细胞凋亡。
该研究利用体内皮下移植瘤和体外T细胞活化等模型,发现在肿瘤的发生发展过程中基底膜蛋白可以直接负调控TCR信号进而下调T细胞的活化、增殖和功能。与前人的研究关注和聚焦T细胞黏附和迁移不同,该研究从T细胞活化的角度阐释了细胞外基质如何在肿瘤微环境中发挥其免疫抑制作用。
分子细胞卓越中心葛高翔研究员和陈剑峰研究员为该论文的共同通讯作者,葛高翔组博士研究生刘祥明为该论文的第一作者。该工作得到了国家自然科学基金委和科技部重点研发计划的经费资助。
文章链接:https://doi.org/10.1093/jmcb/mjac006
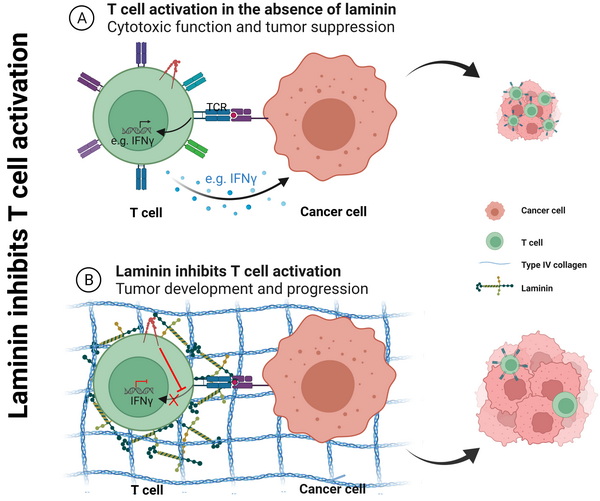
模式图:Laminin抑制T细胞的活化从而促进肿瘤的发生和发展