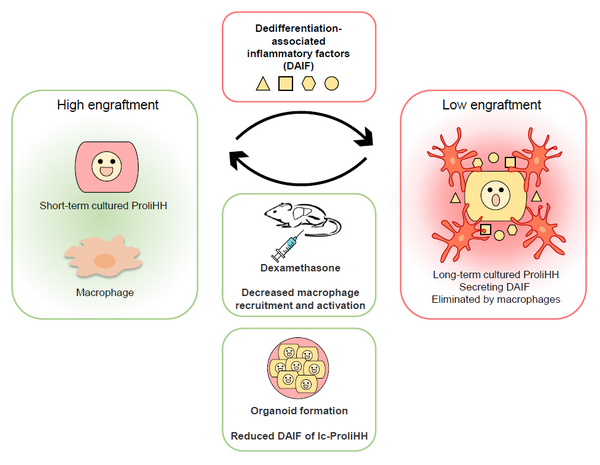
3月1日,国际学术期刊Hepatology在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)惠利健研究组的研究成果“Dedifferentiation-associated inflammatory factors of long-term expanded human hepatocytes exacerbate their elimination by macrophages during liver engraftment”。该研究系统解析了长期培养的ProliHH的分子变化,发现其特异上调表达了一组与固有免疫相关的趋化因子和细胞因子,诱导肝内巨噬细胞过度活化,导致其在移植过程中被特异性清除。针对此现象,研究人员采用了降低受体免疫响应或抑制细胞炎症因子表达的方法,有效地提高了lc-ProliHH的体内移植效率,达到了与PHH接近的水平。
肝细胞移植被证明是治疗遗传性代谢性肝脏疾病和肝功能衰竭的一种有效方案。肝细胞移植在临床上广泛应用的一个关键技术问题是生产大量的具有高效肝脏再殖能力的人肝细胞。虽然肝脏在体内损伤后可以显著再生,但一直以来人原代肝细胞(PHH)的体外扩增始终是领域内亟待突破的瓶颈问题。2018年,惠利健团队在Cell Stem Cell发表文章报道将PHH去分化为一种介于肝细胞和肝前体细胞之的状态,称之为可增殖的人肝细胞(ProliHH)。ProliHH能够在体外培养扩增超过10000倍,满足临床肝细胞移植所需细胞量。当移植到肝脏代谢疾病模型Fah-/-Rag2-/-IL2rg-/-小鼠时,短期扩增的ProliHH(sc-ProliHH)重建肝实质的效果能达到与PHH相当的水平。然而,长期扩增的ProliHH(lc-ProliHH)会出现体内移植效率下降的情况,从而影响长期扩增后人肝细胞的临床移植应用。
肝细胞成功移植到宿主体内有两个重要阶段,分别是早期的定植和后期的体内增殖过程。研究人员首先发现与sc-ProliHH相比,lc-ProliHH的早期定植效率显著下降,而后续的体内增殖过程没有显著差异。进一步通过对两类细胞进行全基因组表达谱分析,发现lc-ProliHH上调表达了一系列与募集和激活固有免疫细胞相关的趋化因子和炎症因子。由于这些因子的表达与肝细胞去分化过程相关,所以将它们统称为去分化相关的炎症因子(dedifferentiation-associated inflammatory factors, DAIF)。这个结果提出了一种可能性,即lc-ProliHH上调表达的DAIF,可能触发移植后免疫细胞的过度招募和激活。体内染色和活体成像证实了lc-ProliHH定植过程中募集了较多的激活型巨噬细胞和中性粒细胞,并且通过氯磷酸盐脂质体敲除宿主的巨噬细胞显著提高了lc-ProliHH的定植。
为实现临床转化,研究人员首先采用了常见药物-糖皮质激素地塞米松(Dex) 抑制lc-ProliHH移植后受体的固有免疫反应。Dex预处理能够有效抑制巨噬细胞和中性粒细胞的的活化,提高了lc-ProliHH的早期定植水平,最终lc-ProliHH的移植效率达到75%,接近于PHH的水平。此外,研究人员通过形成类器官三维培养,使lc-ProliHH重新分化成熟并且降低了DAIF的表达。类器官培养后的lc-ProliHH的早期定植效率显著提高,并且移植效率达到了49%。
综上,此项研究揭示了长期培养人肝细胞移植能力下降的潜在机制,并为ProliHH的临床应用提供了两个策略:(1)抑制受体的固有免疫反应 (2)通过类器官培养降低移植细胞炎症因子的表达。
分子细胞卓越中心博士生王晨华和张鲁狄副研究员为本文共同第一作者。惠利健研究员为本文的通讯作者,并得到上海交通大学医学院上海市免疫研究所王静研究员的协助和支持。该研究得到分子细胞卓越中心动物实验技术平台和细胞分析技术平台的大力支持。该工作得到中国科学院、基金委、科技部等经费支持。
文章链接:https://aasldpubs.onlinelibrary.wiley.com/doi/abs/10.1002/hep.32436