3月5日,国际学术期刊Protein & Cell 以封面论文的形式发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)李劲松研究组的研究成果“ Epigenetic integrity of paternal imprints enhances the developmental potential of androgenetic haploid embryonic stem cells ”。这项工作首次实现小鼠孤雄单倍体胚胎干细胞在体外培养过程中稳定维持父源印记的表观完整性,并进一步提升了该细胞支持半克隆胚胎发育的潜能。
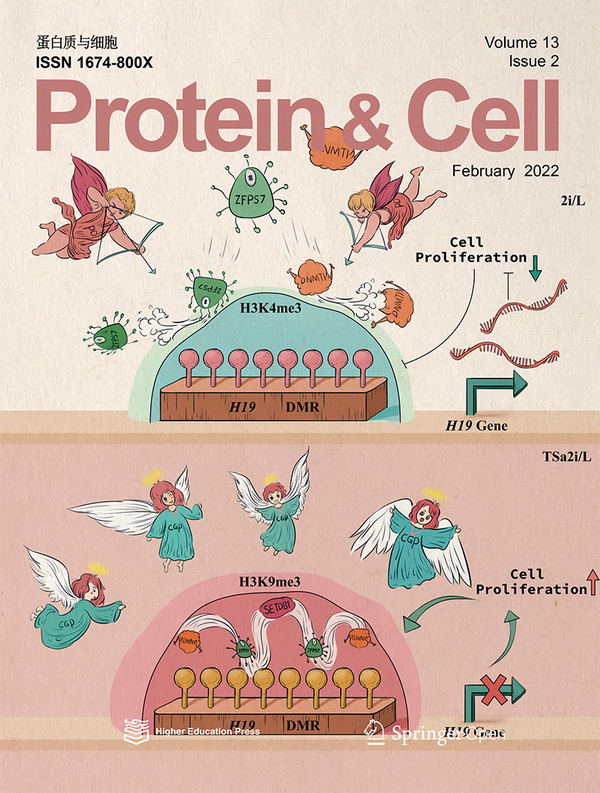
2008年,Austin Smith团队建立了添加Mek1/2抑制剂和Gsk3β抑制剂(2i)的胚胎干细胞(ESCs)培养环境,这种培养基可以使体外培养的小鼠胚胎干细胞获得较好的多能性(pluripotency),极大的推动了小鼠胚胎干细胞研究进程。而然,随着高通量测序技术的发展,对于2i培养环境的细胞进行甲基化测序后发现,由于对Mek1/2信号通路的抑制,这种细胞中的DNA甲基化模式受到了明显的抑制,其中也包括印记调控区域的甲基化模式,进而严重降低了细胞的发育潜能。
2012年,李劲松研究组利用2i培养体系建立了孤雄单倍体胚胎干细胞(又称为类精子干细胞),该细胞可以替代精子支持小鼠胚胎的发育产生半克隆小鼠。但在2i培养环境中,类精子干细胞的印记调控区域DNA甲基化会在培养过程中逐渐丢失,严重降低了半克隆小鼠的发育潜能(2%的半克隆胚胎发育成健康个体),极大的限制了这项技术的应用和发展。2015年,通过在类精子干细胞中敲除两个父源印记调控区域(H19-DMR和IG-DMR)来模拟其甲基化,极大的提高了半克隆小鼠的发育潜能(20%的出生率),但是这种遗传敲除的策略会给其后的应用带来不确定因素。
为了解决上述问题,研究人员尝试对于类精子干细胞的建系和培养过程进行优化,试图在体外培养过程中实现父源印记表观修饰的稳定维持。为此,研究人员对比分析了三种常用的小鼠胚胎干细胞培养环境(S/L,2i/L和a2i/L)的优缺点,并选择a2i/L培养环境进行进一步的改造和优化,最终建立了基于a2i/L培养环境的两步建系的策略(TSa2i)。该策略建立的类精子干细胞在接近60代的培养过程中可以稳定维持父源印记表观修饰的完整性,同时大幅提高了健康半克隆小鼠的出生效率(最高可以达到30%)。
此外,研究人员还发现培养到后期代数的类精子干细胞印记甲基化水平进一步升高,并伴随体内发育能力的增强。究其原因,研究人员发现TSa2i的类精子干细胞H19-DMR的甲基化水平表现出异质性,大部分细胞维持高甲基化而少量细胞会逐渐丢失甲基化。有意思的是,H19-DMR甲基化水平高的细胞较低甲基化水平的细胞有增殖的优势,从而使这些细胞在整体中数量增多,导致类精子干细胞能稳定维持印记甲基化并出现后期代数细胞甲基化水平升高的现象。
基因组印记对于胚胎干细胞体内发育能力起决定性作用,这项工作首次建立了能长期稳定维持雄性印记的类精子干细胞,并提升其发育潜能,为体内遗传筛选提供强大的工具,该研究也为建立稳定维持印记的孤雌单倍体胚胎干细胞提供了新的思路。
分子细胞卓越中心博士生张红玲,博士后李元元和博士生马永健为本文共同第一作者。李劲松研究员为本文的通讯作者。该研究得到分子细胞卓越中心GTP研发中心,动物实验技术平台和细胞分析技术平台的大力支持。该工作得到中国科学院、基金委、科技部、上海市科委等经费支持。
文章链接:https://link.springer.com/article/10.1007/s13238-021-00890-3
模式图:父源印记的表观遗传完整性增强了AG-haESCs的发育潜能