5月18日,国际学术学期Nature在线发表了黄荷凤教授与徐国良研究员领衔,浙江大学、复旦大学和中科院分子细胞科学卓越创新中心等多家单位合作完成的研究成果“Maternal inheritance of glucose intolerance via oocyte TET3 insufficiency”。该研究发现高血糖症可致卵母细胞DNA双加氧酶TET3 (TET methylcytosine dioxygenase 3) 表达水平降低,造成受精后早期胚胎基因组DNA去甲基化障碍,主要表现为胰岛素分泌通路相关基因的启动子DNA异常高甲基化,并将这种高甲基化状态维持至成年期胰岛,进而抑制这些基因的表达而诱发子代呈现糖耐量异常的表型。该工作提示卵母细胞TET3表达和功能异常或可影响子代健康。
流行病学研究显示,孕期不良环境暴露可影响子代健康,因此孕期的健康管理至关重要。然而,育龄妇女孕前期不良内环境是否也能影响卵母细胞发育进而损害子代健康尚不明确。糖尿病的发生率日趋增高且日益低龄化。全世界范围内有2/5的糖尿病妇女处于育龄期,许多病人未得到及时的诊断和治疗。一个亟待回答的科学问题是:这些育龄期妇女孕前期经历的高血糖等不良内环境是否以及如何通过损害卵母细胞进而影响子代健康?
为了解决上述问题,研究者首先以链脲佐菌素(Streptozocin, STZ)诱导的糖尿病雌鼠为模型,使卵母细胞暴露于高血糖环境;再取其卵细胞与正常雄鼠精子进行体外受精;将获得的二细胞胚胎移植至健康的假孕母鼠体内以孕育子代。这种体外受精-胚胎移植(in vitro fertilization-embryo transfer, IVF-ET)实验系统能够排除孕期和产后环境变量对子代的干扰,保证子代表型完全来自暴露于母体不良内环境的卵母细胞。研究者发现,由糖尿病雌鼠卵母细胞受精发育而来的子代小鼠也主要表现为糖耐量受损(impaired glucose tolerance)和胰岛素分泌不足。
为了深入研究高血糖暴露的卵母细胞导致子代糖耐量受损的分子机制,研究者分析了糖尿病雌鼠的MII卵母细胞转录组,发现其母源因子Tet3表达水平显著下降。徐国良研究组曾于2011年在Nature杂志上报道卵细胞来源的TET3主要负责受精卵中父本基因组甲基胞嘧啶的氧化修饰,介导DNA去甲基化。因此,研究者进一步分析了早期胚胎的TET3表达水平和功能,发现暴露于高血糖环境的卵细胞,受精后产生的合子雄原核中的TET3蛋白质水平降低,相应的氧化产物5hmC减少。
随后,研究人员对糖尿病雌鼠的子代胰岛进行了全基因组甲基化测序。结果显示,胰岛素分泌通路(insulin secretion pathway)相关基因的启动子区域DNA高甲基化,包括胰岛素分泌的限速酶:葡萄糖激酶基因Gck (Glucokinase)。以Gck为例,研究者发现胰岛素分泌通路相关基因启动子DNA的异常高甲基化最早出现于受精卵的雄原核,并延续到子代成年小鼠的胰岛,始终维持着父本特异性高甲基化特征。这些结果揭示,在母体高血糖暴露下的卵母细胞,其受精后子代胚胎胰岛素分泌通路相关基因启动子的DNA高甲基化源于受精卵的雄原核,且能持续至成年子代胰岛。
为了明确子代糖耐量异常表型和胰岛素分泌通路相关基因的DNA甲基化谱式改变为卵母细胞TET3表达下降所致,研究者进一步分析了卵母细胞特异性纯合或杂合敲除Tet3的小鼠子代,发现这些子代小鼠也呈现Gck启动子DNA高甲基化与糖耐量受损的表型。此外,在糖尿病小鼠的MII卵母细胞中回补Tet3 mRNA可以在很大程度上恢复Gck启动子DNA甲基化水平和子代表型。
值得注意的是,糖尿病患者的GV期卵母细胞和体外培养的囊胚也分别表现为TET3 表达水平的降低和GCK启动子区域的DNA高甲基化,提示暴露于高血糖环境的人卵母细胞在受精后产生的子代也可能发生代谢综合征。这表明研究者在小鼠模型上的发现也具有重要的临床意义。
综上所述,该研究以小鼠卵细胞暴露于母体高血糖环境模拟人类孕前高血糖环境暴露,深入探讨了卵母细胞TET3介导的子代糖耐量异常的分子机制,提示卵母细胞发育期是一个对环境因素敏感的窗口期;母源TET3及其在受精卵中的表达水平高低和功能正常与否将影响子代健康。该项工作表明:为降低子代出现慢性疾病的风险,将女性基础疾病的预防和筛查提前到孕前期,可能是预防和减少人群中代谢综合征传递的重要策略。该研究也为育龄期健康管理和成人慢性疾病提前防控和生育管理提供了新的理论基础。
复旦大学生殖与发育研究院黄荷凤教授和分子细胞卓越中心徐国良研究员为该论文的共同通讯作者。浙江大学医学院陈宾博士、分子细胞卓越中心杜雅蕊副研究员、孙美玲博士以及王超博士与复旦大学朱虹博士为该文的共同第一作者。该工作还得到了浙江大学医学院盛建中教授、英国阿尔斯特大学Peter R Flatt教授等的大力支持。该工作得到了国家重点研发计划项目、国家自然科学基金以及中科院等的经费支持。该工作得到了分子细胞卓越中心动物平台和细胞平台的帮助与支持。
文章链接:https://www.nature.com/articles/s41586-022-04756-4
同期News & views链接:https://www.nature.com/articles/s41586-022-04756-4
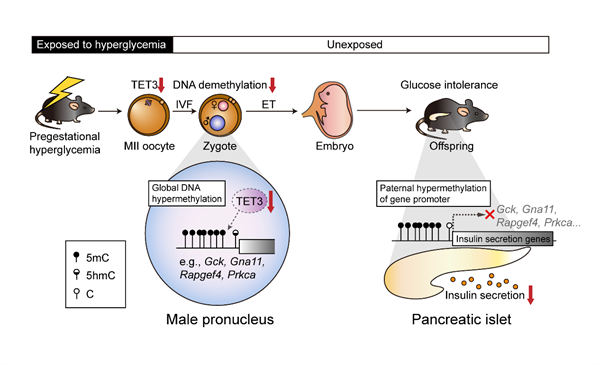
高血糖暴露导致卵细胞DNA双加氧酶TET3表达水平下降,其不足减弱了受精卵的雄原核中胰岛素分泌通路相关基因的DNA去甲基化,从而增加子代发生代谢功能失调的风险。