6月22日,国际学术期刊Development在线发表了中国科学院分子细胞科学卓越创新中心曾艺与景乃禾研究团队的合作研究成果:“Embryonic vascular establishment requires protein C receptor-expressing endothelial progenitors”。该研究成果发现胚胎发育中血管内皮祖细胞的身份属性,更新了血管形成以及循环系统建立的现有认知,同时也更正了先前报道的蛋白C受体(Procr)在胚胎表达的起始时间。同时,该研究提供体内证据来支持内皮祖细胞产生造血干细胞(生血内皮细胞)的假设。这些发现为血管内皮祖细胞的探究提供了分子线索,推进了对血管形态发生和造血内皮细胞到造血细胞转化的认知。
血管生长和重塑是一个持续发生的生理事件,它伴随了所有组织的发育、自稳态维持、为其输送所需的氧气和营养,对生物体内各组织的功能维持起着至关重要的作用。血管系统是胚胎期最早形成的器官之一。然而,胚胎中血管内皮祖细胞的身份属性尚未清楚。曾艺团队前期的研究揭示了成体血管内皮干细胞的特异性蛋白标记物Procr (Cell Research 2016)。为了探究Procr+内皮细胞是否同样存在于胚胎发育早期,团队利用了ProcrmGFP-2A-LacZ报告小鼠模型,通过全胚胎染色,结合胚胎原位杂交、空间转录组数据的分析,展示了胚胎期Procr蛋白表达的起始时间为原肠期的E7.25。这一发现更新了先前研究认为“Procr最早表达在E13.5主血管”的观点。通过谱系示踪实验,团队检验了Procr+ 内皮祖细胞的特性,发现其子代细胞形成的血管网络遍布胚胎的各个组织器官,也贡献于胚外的卵黄囊和胎盘组织中的血管。随后团队对初期血管(8.0-E8.5)、成熟血管(E10.5)以及谱系示踪被标记的Procr+ 细胞的子代细胞进行了单细胞转录组分析,发现:(1)位于血管细胞分化谱系顶端的细胞亚群(内皮祖细胞群)高表达Procr;(2)以内皮祖细胞群为启始的分化路径分别分化出内皮细胞和血液细胞的谱系分支,提示Procr+ 内皮祖细胞可能贡献于血液细胞的产生。这一发现也被Procr-CreER介导的细胞谱系示踪实验进一步验证。最后,团队发现在发育早期特异性杀伤Procr+ 祖细胞导致严重的胚胎、卵黄囊以及胎盘组织血管发育缺陷、胚胎死亡,这表明Procr+ 内皮祖细胞对于早期胚胎血管系统的建立不可或缺。综上,该工作发现了胚胎内皮祖细胞的身份和分子标记,为进一步了解胚胎早期血管发育机理及研究造血内皮细胞的转变和分化提供了新的线索。
俞清副研究员、白蓝月博士和陈莹莹博士为该文的共同第一作者,景乃禾研究员和曾艺研究员为该文的通讯作者。该工作得到分子细胞卓越中心动物实验技术平台、细胞分析技术平台,以及上海营养与健康研究所量化生物学平台陈瑜洁团队的支持。该工作得到了国家自然科学基金委、国家科技部、中国科学院青年促进会的资金支持。
文章链接:https://doi.org/10.1242/dev.200419
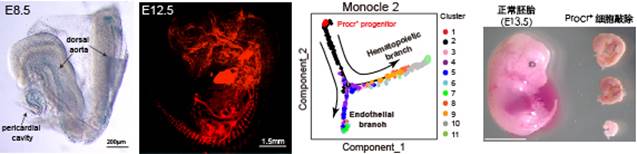
图示:(左一)胚胎期E8.5天血管形成期间Procr的表达(蓝色标记)。(左二)胚胎期E12.5天由Procr+ 祖细胞及后代形成的血管网络(红色荧光标记)。(右二)发育路径分析展示Procr+祖细胞分化为成熟的内皮和血液细胞。(右一)Procr+祖细胞的敲除阻碍血管、血液的形成,严重影响胚胎的正常发育。