12月12日,国际学术期刊Nucleic Acids Research在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周小龙研究组与王恩多研究组的最新合作研究成果“RNA granule-clustered mitochondrial aminoacyl-tRNA synthetases form multiple complexes with the potential to fine-tune tRNA aminoacylation”。
人基因组含有37个氨基酰-tRNA合成酶(aminoacyl-tRNA synthetase, aaRS)基因,负责编码细胞质和线粒体两套蛋白质合成系统使用的所有aaRS。aaRS催化tRNA氨基酰化反应,生成氨基酰-tRNA,保证蛋白质合成的速度和精确性。相比较于细菌来源的aaRS,哺乳动物细胞质aaRS通常含有N端或者C端的延伸,负责介导蛋白质和蛋白质之间的相互作用,例如9种人细胞质aaRS和3种非酶辅助因子形成细胞质多aaRS复合物(MSC)。MSC的形成对于蛋白质合成的效率以及aaRS行使非蛋白质合成功能具有重要意义。除了人细胞质MSC,细菌、古菌和酵母中也存在简单的含aaRS的复合物或MSC。19种人线粒体aaRS由核基因编码。虽然整套人线粒体aaRS在20年前就已被鉴定,但是人线粒体aaRS的亚细胞器定位及相互作用蛋白质网络尚未系统建立;人线粒体aaRS的活力调控方式也并不清楚。
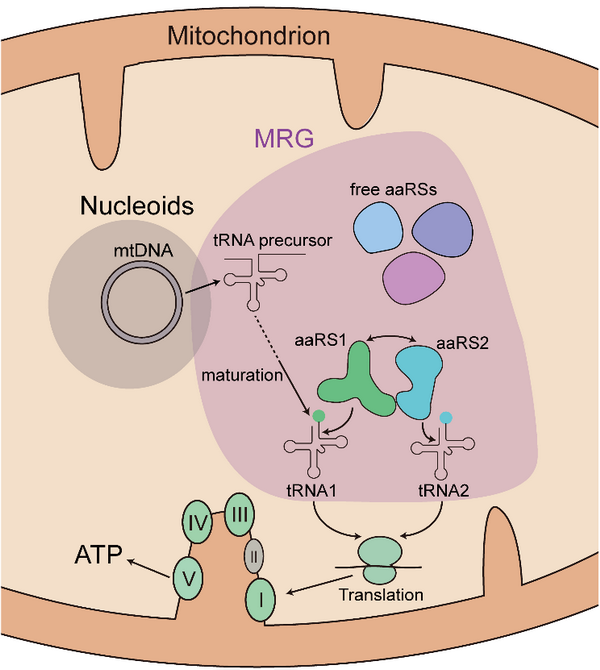
线粒体RNA颗粒(mitochondrial RNA granules, MRG)是近年来发现的由蛋白质和RNA组成的动态亚细胞器结构,参与线粒体RNA的加工、成熟和核糖体的生成。MRG的蛋白质组学和荧光实验揭示多个与RNA代谢相关的线粒体蛋白质分布其中,包括tRNA加工酶RNase P和RNase Z,rRNA甲基转移酶和 tRNA 修饰酶等。虽然多个线粒体aaRS在 MRG蛋白质组学中被发现,但是一直缺乏具体的实验证据。
本研究中,研究人员首先分析了人线粒体aaRS与细菌及真核细胞质aaRS的一级结构,揭示人线粒体aaRS从进化上与细菌来源的aaRS同源性更高;克隆和表达了人全套线粒体aaRS基因;通过共聚焦和超高分辨率显微镜,发现19种线粒体aaRS部分定位在MRG中;进一步构建没有tRNA结合能力的线粒体aaRS突变体,揭示tRNA结合能力对于线粒体aaRS定位在MRG中至关重要;利用免疫沉淀和质谱(IP-MS)联用的方法,系统建立了19种人线粒体aaRS的相互作用网络;进一步通过免疫共沉淀、蛋白质共纯化、体外重组等方法,揭示了多个线粒体aaRS形成MSC,包括线粒体丙氨酰-tRNA合成酶(mtAlaRS)-线粒体丝氨酰-tRNA合成酶(mtSerRS)相互作用、线粒体天冬酰胺-tRNA合成酶(mtAsnRS)-mtSerRS相互作用、线粒体酪氨酰-tRNA合成酶(mtTyrRS)-mtSerRS相互作用、线粒体精氨酰-tRNA合成酶(mtArgRS)-线粒体苏氨酰-tRNA合成酶(mtThrRS)相互作用等;进一步通过体外活力重组实验证明,线粒体MSC的形成对于特定亚基的氨基酰化活力具有调节作用。
本研究明确了所有的线粒体aaRS部分定位于MRG中,阐释了线粒体aaRS进入MRG的潜在分子基础;建立了全套线粒体aaRS的相互作用网络并发现若干线粒体MSC;揭示了线粒体MSC形成对线粒体不同tRNA的氨基酰化效率的协同调节作用。这些研究结果加深了人们对线粒体aaRS的亚细胞器定位、相互作用网络和活力微调机制的认识,为揭示线粒体aaRS基因突变导致相关疾病的分子机制提供了新视角。
分子细胞卓越中心与上海科技大学联合培养博士研究生彭桂鑫和分子细胞卓越中心博士研究生毛雪玲为本文共同第一作者,周小龙研究员和王恩多研究员为本文共同通讯作者。分子细胞卓越中心李青润博士、厦门大学陈鑫教授参与了该研究。该工作得到了科技部国家重点研发计划、基金委、中科院、上海市的经费资助。
文章链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkac1141/6887605
线粒体aaRS的亚细胞器定位、相互作用和活力微调机制