1月10日,国际学术期刊Cell Discovery在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周斌研究组与复旦大学附属中山医院王利新研究组合作的研究文章“Coronary vessels contribute to de novo endocardial cells in the endocardium-depleted heart”。该研究利用双同源重组酶介导的谱系示踪技术揭示了心脏冠状血管转变为心内膜的潜能。
在心脏的发育过程中,冠状血管主要来源于两群祖细胞,第一群祖细胞为将血液循环回心脏的静脉窦(sinus venous, SV),另一群祖细胞则是排列在心腔内的内皮细胞层,也即心内膜(endocardium)。在小鼠的心脏中,静脉窦来源的冠状血管主要分布在心室壁的外侧,而心内膜来源的冠状血管主要分布在心室壁的内侧。先前已有文章表明,在静脉窦来源的冠状血管缺失时,心内膜来源的冠状血管能够向外扩展并代偿缺失的冠状血管。尽管在成体心脏中,心内膜贡献给冠状血管的能力丧失,但在特定的损伤条件以及生长因子的刺激下,这个过程又会被重新激活,这表明了在心脏的修复与再生过程中有着强大的细胞可塑性。另外,心内膜在心脏的发育过程中会贡献到心脏的多种细胞谱系,如成纤维细胞、周细胞、平滑肌细胞、脂肪细胞等,而且心内膜在心脏瓣膜形成及心脏正常功能维持中都起着重要作用,这些表明了心内膜在心脏生长以及稳态维持中有着至关重要的角色。尽管近些年来心内膜向内皮细胞的转变已经被深入研究,但冠状血管内皮是否能逆转回心内膜细胞仍然未知。揭示特定细胞转换回祖细胞状态的可塑性对干细胞研究和再生医学应用至关重要,因此研究人员探究了冠状血管转换为心内膜的能力。
为了高效标记心内膜细胞,研究人员首先利用心内膜的标记物NPR3构建了Npr3-tTA的基因敲入小鼠,通过获得Npr3-tTA;TetO-Cre;R26-lsl-tdT小鼠,其中tTA结合到TetO序列并激活下游Cre重组酶的表达,用于NPR3+心内膜细胞的谱系示踪,对出生后第2天小鼠的心脏进行全组织荧光拍照以及免疫荧光染色拍照,在心脏左右心房以及心内膜以及室间隔中均出现了tdTomato+的细胞,证明了用于心内膜遗传靶向的TetO系统的成功构建。先前已有研究利用白喉毒素受体(DTR)清除祖细胞来探究子代细胞转变为祖细胞的潜能,因此研究人员利用Npr3-tTA;TetO-Cre系统去清除心内膜细胞并检测冠状血管内皮贡献到心内膜细胞的潜能。由于心内膜细胞除了血管内皮细胞外还贡献到多种其他细胞谱系,而且NPR3也表达在心外膜中,研究人员使用NPR3与泛内皮细胞的标记物CDH5的交集来特异性地清除心内膜细胞及其衍生的内皮细胞。为此,研究人员构建了Cre-loxp激活的可诱导性的内皮细胞特异性的DTR小鼠品系(Cdh5-lsl-tdT-DTR),实验结果证明tdTomato以及DTR的表达是Cre重组酶依赖的,并且是内皮细胞特异性的,因此表明了Cdh5-lsl-tdT-DTR小鼠品系成功构建。
通过对获得的Npr3-tTA;TetO-Cre;Cdh5-lsl-tdT-DTR小鼠进行全组织荧光拍照以及免疫荧光染色拍照,研究人员证明了tdTomato与DTR表达在NPR3+心内膜及其衍生的内皮细胞。研究人员对新生小鼠注射白喉毒素(DT)后不同时间点进行收样分析,通过对心内膜细胞的标记物PLVAP以及tdTomato进行染色发现,注射DT后第五天,几乎所有的tdTomato+的细胞都被清除了并开始了心内膜的重塑。通过TUNEL实验证明了DT确实诱导了大量细胞凋亡。通过对DT清除后5天的心脏连续切片进行tdTomato以及内皮细胞标记物CD31免疫荧光染色,结果表明,DT处理的小鼠心脏中会有冠状血管与心内膜连接的现象,而在没有DT处理的心脏中则没有这样的连接现象存在。这些结果表明冠状血管可能参与心内膜的修复过程。
为了进一步探究冠状血管是否能够在心内膜清除的情况下贡献到心内膜中去,研究人员利用了在新生小鼠冠状血管中大量表达但不在心内膜表达的标志物APLN,研究人员交配得到Apln-DreER;R26-RSR-GFP; Npr3-tTA;TetO-Cre; Cdh5-lsl-tdT-DTR双同源重组系统小鼠,以此在清除心内膜细胞内皮谱系的同时,将冠状血管遗传标记上GFP荧光蛋白。研究人员给新生期1天(P1)的小鼠给予他莫昔芬处理并在P3天给予DT处理,在P14进行收样分析。免疫荧光染色结果表明在DT处理后的心脏中出现了GFP+CD31+的心内膜细胞,并通过对PLVAP免疫荧光染色证明了心腔内侧GFP+的细胞确实是心内膜细胞。统计结果表明GFP+的冠状血管贡献到2.06 ±0.31%的心内膜。而在没有DT处理的心脏中则没有GFP+的心内膜细胞出现。给予R26-RSR-GFP; Npr3-tTA;TetO-Cre; Cdh5-lsl-tdT-DTR小鼠DT处理后,也没有在心脏中发现GFP+的细胞出现,表明没有发生Cre-rox的交叉重组,进一步证明了该系统的可信性。以上结果表明在心内膜清除的情况下,冠状血管能够转变为心内膜细胞。为了进一步更详细地探究冠状血管向心内膜的转变过程,研究人员给P1注射了他莫昔芬的新生小鼠在P3注射了更低剂量的DT,通过对心脏切片进行免疫荧光染色分析,在P7的心脏切片中发现了与心内膜相连通的GFP+的冠状血管,并且在P14的心脏切片中发现了折叠进心室壁的GFP+PLVAP+的心内膜细胞以及GFP+PLVAPlow的细胞与PLVAP+的心内膜相连接的现象,以上这些结果都表明了血管内皮能够动态持续转换为心内膜细胞来参与心内膜的损伤后重建。另外,通过对P1注射了他莫昔芬的成体Apln-DreER;R26-RSR-GFP; Npr3-tTA;TetO-Cre; Cdh5-lsl-tdT-DTR小鼠进行DT处理,研究人员发现成体小鼠心脏的冠状血管内皮细胞在心内膜清除后仍保持着转变为新的心内膜细胞的潜能。
综上,周斌组研究人员构建了两个新的小鼠品系Npr3-tTA与Cdh5-lsl-tdT-DTR来实现特异性清除心内膜及其衍生的内皮细胞谱系,随后研究人员利用双同源重组系统实现了在清除心内膜的同时示踪冠状血管内皮细胞,结果表明残留的冠状血管内皮会向心内膜迁移并与与其连通,通过进一步表达心内膜的标志物转变为心内膜细胞。该研究揭示了冠状血管内皮细胞产生新心内膜细胞的高度细胞可塑性,并再次证明了尽管祖细胞-衍生细胞的层次结构被建立,但在这些离散的内皮细胞类型之间的边界可以在诱导基因程序激活时被覆盖。
分子细胞卓越中心博士生张铭珺和副研究员蒲文娟为该论文共同第一作者。分子细胞卓越中心周斌研究员与复旦大学附属中山医院王利新医生为该论文的共同通讯作者。该工作也得到了牛津大学Nicola Smart的大力支持。感谢分子细胞卓越中心动物平台和细胞分析技术平台对本研究的大力支持,感谢中科院、基金委、科技部以及上海市科委等部门的经费支持。
文章链接:https://www.nature.com/articles/s41421-022-00486-z
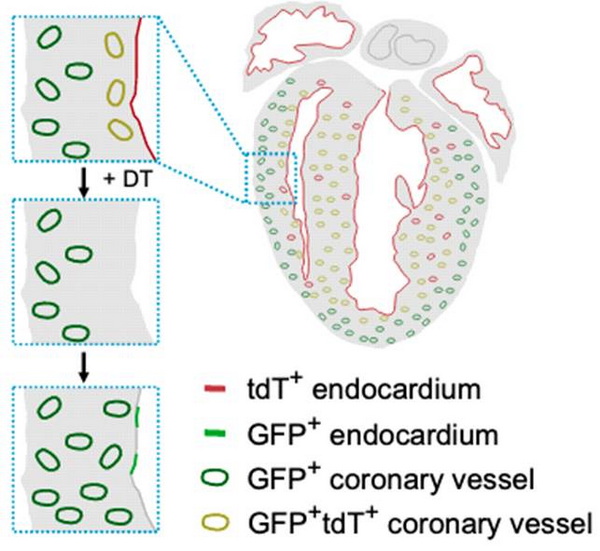
冠状动脉内皮细胞在心内膜细胞清除后转化为心内膜细胞