2月10日,国际学术期刊Journal of Molecular Cell Biology(JMCB)在线发表了中国科学院分子细胞科学卓越创新中心丁建平研究组和杨荟研究组的研究成果“Caenorhabditis elegans NMAD-1 functions as a demethylase for actin”。
丁建平研究组长期从事真核生物表观遗传调控机制的研究,综合利用结构生物学、生物化学和细胞生物学等手段阐释了多种表观修饰酶对底物识别和催化的分子机制。此次,他们报道了秀丽隐杆线虫(Caenorhabditis elegans)中Alkb家族蛋白NMAD-1以Fe2+/α-KG依赖的方式催化肌动蛋白第84位赖氨酸单甲基化(K84me1)的去甲基化活性,并解析了NMAD-1结合底物类似物NOG和Mg2+的晶体结构,为后续探究NMAD-1的生理功能提供了线索。
DNA N-6甲基腺嘌呤(6mA)是原核生物中广泛存在的表观遗传修饰,但高等真核生物是否存在6mA修饰仍存在争议。近年来,多个课题组相继在多种不同真核生物中发现6mA的存在,并鉴定出多种与6mA相关的DNA甲基转移酶和去甲基化酶,但除METTL4和ALKBH1两种哺乳动物6mA效应蛋白外,仍有多种6mA相关修饰酶缺乏深入实验验证。研究发现,秀丽隐杆线虫基因组存在6mA修饰,6mA的修饰水平受到DNA去甲基化酶NMAD-1和潜在DNA甲基转移酶DAMT-1的共同调控。NMAD-1属于Alkb家族,可以通过Fe2+/α-KG依赖的方式在体内和体外催化单链DNA、双链DNA上6mA修饰的去甲基化。
丁建平研究组和杨荟研究组合作对NMAD-1的底物特异性、功能和分子机制进行了深入研究。基于体外结合实验分析,他们发现重组NMAD-1不具有结合DNA的能力。由于NMAD-1与人源ALKBH4具有高度的同源性,而人源ALKBH4被认为与肌动蛋白K84me1的修饰水平相关,这激励他们对NMAD-1是否具有肌动蛋白去甲基化活性进行了探索。通过质谱检测,他们发现野生型线虫存在与人源肌动蛋白K84me1同源的线虫肌动蛋白K85me1修饰;而在NMAD-1缺陷的突变体线虫中,该修饰水平明显提高(图A),这些发现提示NMAD-1可能作为一类蛋白去甲基化酶,调控肌动蛋白K85me1修饰水平。体外生化实验也显示,NMAD-1能够直接结合并催化肌动蛋白K84me1的去甲基化(图B,C)。他们解析了NMAD-1结合底物类似物NOG和Mg2+的晶体结构(图D)。结构分析表明,与其他Fe2+/α-KG依赖的双加氧酶类似,NMAD-1的催化核心采取一个保守的DSBH(double-stranded α-helix)折叠方式,其中金属离子和NOG结合在位于DSBH开放一侧的活性反应中心。活性反应中心关键氨基酸的突变体酶活实验表明,NMAD-1的活性依赖于金属离子和α-KG的正确结合。由Flip1和Flip2 基序(motif)构成的NRL (nucleotide reorganization lid)结构域位于DSBH开放的一侧,Flip1和Flip2相互远离呈现开放的构象,使得活性反应中心暴露在溶液中。NMAD-1独特的NRL结构域与底物的识别相关。不同于其他具有DNA/RNA去甲基化酶活性的Alkb家族蛋白,NRL结构域并未在NMAD-1的活性反应中心附近形成带有连续正电荷的核酸结合口袋,而是形成了一个较为疏水且开放的底物结合区域(图E),该区域与肌动蛋白K84位点附近的结构在形状和电荷环境上互补。此外,他们还发现NMAD-1的C末端结构域(CTD)与NRL结构域相互作用、并稳定了NRL结构域的构象。当对NMAD-1的CTD截短后,NMAD-1活性反应中心保持完整,但失去了结合底物肌动蛋白的能力,造成NMAD-1对肌动蛋白K84me1去甲基化活性的丧失(图F),进一步表明NRL结构域在NMAD-1的底物识别过程中发挥着重要作用。这些研究结果阐明了NMAD-1催化肌动蛋白K84/85me1去甲基化的分子机制。
分子细胞卓越中心与上海科技大学联合培养博士研究生石雨为该论文第一作者,丁建平研究员和杨荟研究员为该论文的共同通讯作者。该研究工作得到了国家蛋白质科学研究设施(上海)BL19U1线站、分子细胞科学卓越创新中心分子平台的技术支持,以及国家重点研发计划的经费支持。
文章链接:https://doi.org/10.1093/jmcb/mjad008
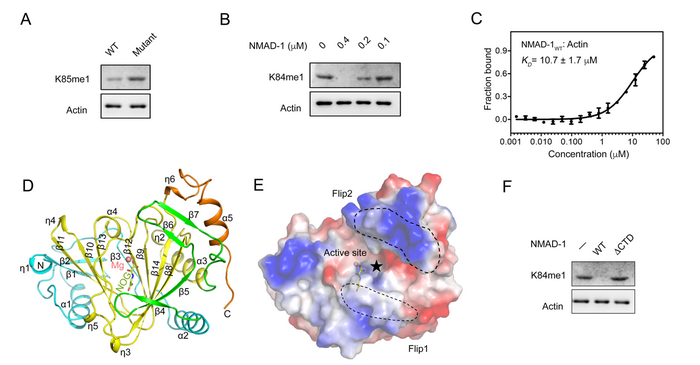
NMAD-1催化肌动蛋白K84/85me1去甲基化的分子机制