3月8日,国际学术期刊Cell Research在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)许琛琦研究组、上海科技大学生命科学与技术学院王皞鹏课题组、复旦大学附属眼耳鼻喉科医院吴海涛团队、上海市第一人民医院宋献民课题组的合作研究成果: “Tuning Charge Density of Chimeric Antigen Receptor Optimizes Tonic Signaling and CAR-T Cell Fitness” ,并被杂志列为精选论文(Featured Article)。该论文阐明CAR-T细胞中基底信号形成机制,并开发了基于基底信号调控的CAR理性设计平台, 为推进CAR-T细胞治疗实体瘤提供新策略。
CAR-T细胞治疗是通过在T细胞上表达嵌合型抗原受体(Chimeric Antigen Receptor, CAR),使其在患者体内识别并杀伤肿瘤细胞的一种肿瘤免疫疗法。CAR-T疗法在血液肿瘤的治疗中展现出显著效果,多种CAR-T细胞产品已获批上市,但在治疗实体瘤方面一直疗效不佳,其中一个重要原因是CAR-T 细胞容易功能耗竭。这一直是实体肿瘤CAR-T治疗的瓶颈所在。
近期研究发现,多数实体肿瘤CAR受体在无肿瘤抗原刺激时,仍然会产生一种持续的基底信号,而这种基底信号会持续刺激CAR-T细胞,导致后者功能耗竭。同时,基底信号的过度不足也会影响CAR-T细胞的持续和疗效。因此,了解基底信号形成和维持的机制是解决上述难题的关键。
本工作中,研究人员首次揭示了CAR受体表面正电荷斑块(PCP)介导的静电作用是基底信号的重要发生机制。研究发现,大多数靶向实体瘤的CAR-T细胞往往会因为基底信号强度过高导致自发耗竭,可以通过提高盐离子浓度或者缩小PCP的方法来减弱实体瘤CAR-T细胞的基底信号,提高它们的体内生存优势。然而,某些治疗血液肿瘤的CAR-T细胞会因为基底信号强度不足导致持续能力不够,如CD19、CD22 CAR等,可通过增大PCP的方法来增强该类CAR-T细胞的基底信号,增强它们的体内持续能力。
本工作还建立了CAR理性设计的理论体系,能为CAR的结构设计提供评价指导和功能预测,大大加速CAR-T的研发效率和进程,进而推动肿瘤尤其是实体瘤CAR-T治疗研究领域的发展。王皞鹏研究员、吴海涛教授、许琛琦研究员和宋献民教授为共同通讯作者。该项研究工作得到了中科院青年团队及上海市基础特区研究项目等资助。
文章链接:https://www.nature.com/articles/s41422-023-00789-0
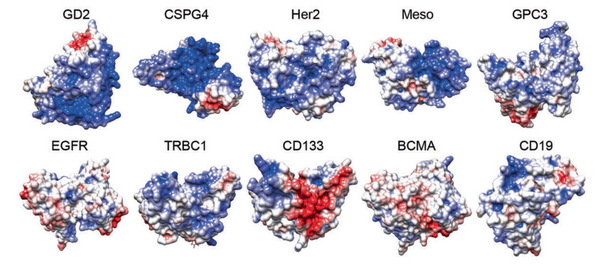
CAR受体表面电荷的分布
(临床中常见的10种CAR的设计。其中蓝色为正电荷基团,红色为负电荷基团。)
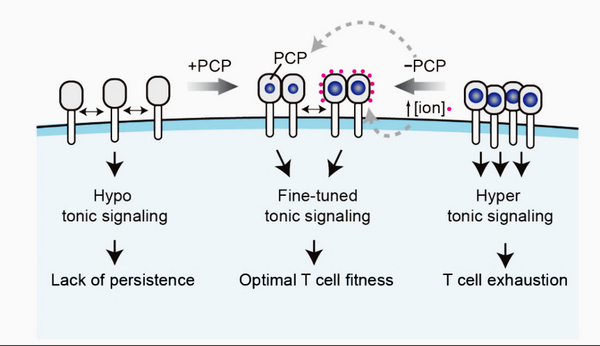
CAR-T基底信号的产生机制与调控方法