3月15日,国际学术期刊Science Advances在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)丛尧研究组题为 “Structural basis of plp2-mediated cytoskeletal protein folding by TRiC/CCT” 的研究论文。研究人员应用冷冻电镜结合交联质谱技术,捕获了辅伴侣plp2协同TRiC在ATP驱动的构象循环中协助tubulin/actin折叠的过程,首次解析了TRiC-plp2-tubulin复合体结构,揭示了主要的细胞骨架蛋白tubulin/actin在蛋白质折叠机器TRiC与辅伴侣plp2的协同帮助下正确折叠的分子机制,扩展了对细胞骨架蛋白稳态与相关人类疾病之间联系的理解。
蛋白质的正确折叠对维持细胞内环境的稳态有重要作用。真核生物Ⅱ型分子伴侣素TRiC/CCT在ATP驱动下发生构象变化,协助约10%的胞质蛋白正确折叠。其底物包括许多重要的结构性和调节性蛋白,如细胞骨架蛋白tubulin和actin,细胞周期调控因子和与肿瘤发生密切相关的蛋白等。因此,TRiC结构或功能的异常与癌症和神经退行性疾病密切相关。主要的细胞骨架蛋白—tubulin和actin参与调控众多的生物进程,它们均为TRiC的固有底物。在tubulin/actin的生物发生(biogenesis)中,TRiC与辅助分子伴侣 PhLP2协作起着关键作用,它们的活性也关系到依赖细胞骨架完整性的细胞过程。然而,由于结构信息有限,在ATP驱动的TRiC构象循环过程中,PhLP2 如何与TRiC协调进而协助细胞骨架蛋白tubulin、actin折叠的分子机制亟待阐明。
本项研究中,研究人员解析了酵母源TRiC在plp2(酿酒酵母中PhLP2的同源类似物)和底物tubulin/actin同时存在条件下,在ATP酶驱动的构象循环中的系列冷冻电镜结构,分辨率最高达到3.05 埃。在TRiC开环的S1和S2状态下,plp2和底物均与TRiC结合且各占据TRiC的一个腔(chamber);且底物比较动态,处于折叠初始状态。有趣的是,在首次解析的关环的TRiC-plp2-tubulin复合体(S3)结构中,发现一个?-tubulin在TRiC的腔室内已达到天然折叠状态,且自其“诞生”就加载了一个GTP;同时plp2占据对面的腔室。这也为tubulin的生物发生及???-tubulin异二聚体的组装提供了新的线索。研究发现同时获得了关环的TRiC-plp2-actin结构(S4),观测到折叠中间态的actin及对面腔室中的plp2。随着TRiC关环,plp2在TRiC腔内发生了较大的易位(translocation)来协调底物蛋白在TRiC另一腔内CCT6亚基一侧的位置移动,促进底物的稳定和折叠。此外,无论TRiC处于开、关环状态,辅伴侣plp2均结合在TRiC的一个腔内,但其他TRiC的辅伴侣如PFD和PhLP1则只结合在开环TRiC的外顶部。
该研究揭示了辅伴侣plp2协同TRiC/CCT,在ATP驱动下协助主要细胞骨架蛋白tubulin及actin折叠的动态过程和结构机制,及plp2在此过程中促进底物稳定和折叠的功能。该研究为tubulin的生物发生及???-tubulin异二聚体的组装提供了新的线索,加深了对细胞骨架蛋白稳态与相关人类疾病之间联系的理解。
分子细胞卓越中心丛尧研究员为本文的通讯作者,博士生韩文玉为本文的第一作者,国家蛋白质科学中心(上海)彭超博士等提供了质谱分析。感谢分子细胞卓越中心鲍岚研究员、朱学良研究员对本项目的大力支持。该研究得到国家蛋白质科学研究(上海)设施的冷冻电镜系统、数据库与计算分析系统、质谱系统、规模化蛋白质制备系统的大力支持。该研究获国家自然科学基金委、国家科技部、中国科学院战略性先导科技专项(B类)等资助。
文章链接:https://www.science.org/doi/10.1126/sciadv.ade1207
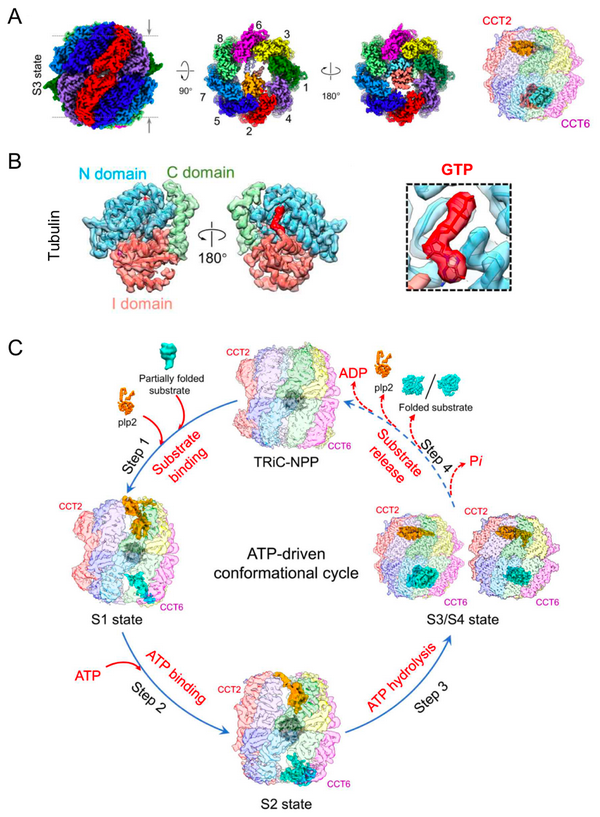
(A)关环的TRiC-plp2-tubulin复合体的冷冻电镜结构;(B)该结构中TRiC内部结合的tubulin及其加载的GTP的结构细节;(C)TRiC-plp2协同在TRiC的ATP酶构象循环过程中协助主要细胞骨架蛋白tubulin/actin折叠的过程示意图。