3月23日,国际学术期刊Nature Genetics在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周斌研究组发表的研究论文“Dual genetic tracing reveals a unique fibroblast subpopulation modulating cardiac fibrosis”。
周斌研究组科研人员开发了双同源重组酶介导的遗传谱系示踪系统来特异性追踪心内膜起源的成纤维细胞(Endocardium-derived fibroblast, EndoFb),揭示了EndoFb是调节心脏纤维化的独特成纤维细胞亚群。利用EndoFb-tracer系统,研究人员发现在心脏发育和成体稳态情况下EndoFb具有非常明显的区域性分布特征,在心脏压力负荷下(TAC模型),EndoFb比其他成纤维细胞亚群更具增殖潜能。通过Fb-ProTracer系统,研究人员实现了不依赖于预先标记成纤维细胞亚群、无偏好地评估成纤维细胞在稳态或损伤后的增殖情况,揭示了TAC后成纤维细胞的增殖区域性。利用EndoFb-DTR系统,研究人员在遗传学水平上特异性清除EndoFb,发现EndoFb清除后可显著缓解TAC引起的心脏纤维化并减缓了心脏衰竭的进程,证实了EndoFb调控心脏纤维化和病理性心肌重塑。通过构建成纤维细胞亚群特异性基因敲除Ctnnb1-KO系统,揭示Wnt信号通路是TAC后调控EndoFb扩张的重要分子机制。
心力衰竭每年都会导致全球范围内大量的个体致病或死亡。相较于其他组织器官,哺乳动物心脏是成体动物所有组织器官中再生能力最差的器官,这主要归因于心肌细胞薄弱的增殖潜能。事实上,心肌细胞只占成体哺乳动物心脏中所有细胞的大约30%,心脏中的非心肌细胞,包括内皮细胞,成纤维细胞,周细胞,平滑肌细胞以及造血细胞等是心脏中其他主要的细胞类型。其中,心脏成纤维细胞对于维持心脏的基本结构与功能,以及在病理条件下调节心脏重塑起着关键作用。在心脏损伤早期,心脏成纤维细胞被激活并分化成具有收缩性的肌成纤维细胞,产生大量的胞外基质,生成富含胶原的疤痕,修补由于心肌死亡导致的心脏缺损,维持心脏基本功能。然而,成纤维细胞增殖过多会导致胞外基质的过度积累并导致心脏弹性减弱,降低心室壁的顺应性,从而严重影响心脏功能,最终促使心力衰竭。因此,了解驱动心脏纤维化病理过程的基本机制,对于把控成纤维细胞在心脏损伤后的适度增殖,更大程度地发挥成纤维细胞保护心脏功能的作用至关重要,并为开发治疗心脏纤维化的潜在靶标提供新的思路和见解,对缓解心脏衰竭、提高患者生存质量具有临床指导意义。
之前的研究主要用单同源重组酶介导的谱系示踪方法,通过心内膜的遗传工具小鼠和心外膜的遗传工具小鼠去研究心内膜衍生的成纤维细胞和心外膜衍生的成纤维细胞。然而,传统的遗传谱系示踪方法虽然能够示踪到不同的成纤维细胞亚群,但是由于心内膜细胞和心外膜细胞还会贡献给许多其他细胞类型,包括血管内皮细胞、周细胞、平滑肌细胞、脂肪细胞等,这些细胞类型的存在不仅会干扰研究人员对成纤维细胞在稳态和损伤情况下的表型探究,也无法仅对成纤维细胞进行特异性的遗传操作,这就使得探究不同成纤维细胞亚群对心脏纤维化和心力衰竭影响的潜在机制成为一个难题。
本研究中,研究人员首先构建了高效稳定的特异性追踪心内膜来源的成纤维细胞亚群的遗传学模型,为探究EndoFb在心脏纤维化过程中的细胞及分子机制研究奠定基础。研究人员将心内膜的工具小鼠Nfatc1-Dre,成纤维细胞的工具小鼠Col1a2-CreER,与双系统报告基因小鼠R26-RL-GFP交配,产生Nfatc1-Dre;Col1a2-CreER;R26-RL-GFP(EndoFb-tracer)小鼠。在该系统中,Dre-rox重组去除第一个Stop,随后的Cre-loxP重组在他莫西芬(Tam)诱导下去除第二个Stop,实现了用GFP报告基因永久遗传标记EndoFb。在发育的心脏中对EndoFb-tracer小鼠进行Tam注射,研究人员发现GFP+的EndoFb主要分布在室间隔的上半部分和左心室的小梁心肌层,较少分布于右心室以及左心室的致密心肌层。为了在成体损伤情况下高效标记EndoFb和其他成纤维细胞亚群,研究人员在EndoFb-tracer系统中引入R26-LSL-tdTomato报告基因小鼠,在Nfatc1-Dre;Col1a2-CreER;R26-RL-GFP;R26-LSL-tdTomato四基因小鼠中,EndoFb被标记成GFP+tdTomato+,其他来源的成纤维细胞(主要是EpiFb)被标记为GFP–tdTomato+。通过流式细胞术和EdU掺入实验,研究人员发现,TAC损伤后EndoFb的扩增潜能明显高于其他来源的成纤维细胞,且在纤维化区域高度富集。
为了在心脏损伤后无偏好地评估成纤维细胞的增殖情况,研究人员在最近报道的体内细胞增殖示踪技术ProTracer的基础上,设计了成纤维细胞特异的Fb-ProTracer系统。利用Col1a2-CreER这个成纤维细胞工具小鼠,结合Ki67-LSL-2A-Dre,以及双系统报告基因小鼠R26-RL-GFP,获得Col1a2-CreER;Ki67-LSL-2A-Dre;R26-RL-GFP(Fb-ProTracer)小鼠。在该系统中,Tam会诱导Col1a2-CreER中的CreER入核以去除Ki67-LSL-2A-Dre中的Stop序列,产生一个新的Ki67-2A-Dre等位基因;并去除R26-RL-GFP等位基因的第一个Stop序列,注射Tam后,Ki67-2A-Dre将切除增殖的成纤维细胞中的第二个Stop序列,并开始连续记录增殖的成纤维细胞。对TAC后的Fb-ProTracer小鼠进行分析,研究人员发现GFP+的成纤维细胞主要集中在室间隔和左心室的上半部分,该表型与EndoFb在TAC损伤后的区域性扩张高度一致,进一步提示EndoFb在TAC损伤后增殖的活跃性以及EndFb在该损伤模型下对纤维化的重要贡献。
为了探究TAC损伤后EndoFb对心脏纤维化的在体功能,研究人员构建了Nfatc1-Dre;Col1a2-CreER;R26-LSL-RSR-tdT-DTR(EndoFb-DTR)小鼠,在该系统中,Dre-rox和Cre-loxP重组同时介导了tdTomato和白喉毒素受体(DTR)在EndoFb中的专一性表达。对EndoFb-DTR小鼠进行Tam注射,可将EndoFb标记成红色,对EndoFb-DTR小鼠进行DT处理,又可实现对tdTomato+的EndoFb遗传性清除。在TAC后第8天对EndoFb-DTR小鼠进行DT注射以清除EndoFb,在TAC后第28天收集EndoFb-DTR小鼠心脏进行组织学分析,结果表明,与PBS处理的对照组相比,DT处理组的小鼠心脏纤维化程度减弱,心脏肥大水平下降,心肌细胞大小更接近野生型小鼠。对PBS处理组小鼠和DT处理组小鼠进行心脏功能连续监测,统计结果表明,DT处理组小鼠心脏功能下降趋势相较于PBS处理组小鼠明显减缓。综合以上数据,研究人员认为EndoFb对TAC后的心脏纤维化具有重要贡献,减少EndoFb在TAC后的数量将有效保护心脏功能,减缓心脏衰竭进程。
鉴于EndoFb在TAC损伤后具有更强的增殖潜能,且在TAC后消除EndoFb在一定程度上减轻了心脏纤维化,为探索调控EndoFb潜在的分子机制,研究人员从EndoFb-tracer小鼠的心室中分离出GFP+和GFP–的成纤维细胞进行RNA-seq分析。在假手术(Sham)组和TAC组的心脏中,跟成纤维细胞激活有关的基因,如Thbs4、Cilp、Postn、Comp、Fmod、Cthrc1和Ddah1,在GFP+的成纤维细胞中表达均比其在GFP–的成纤维细胞中的表达更高。基因富集分析显示,与GFP–的成纤维细胞相比,GFP+的成纤维细胞中的Wnt信号通路和成纤维细胞增殖通路均受到正向调节。基因表达热图表明,与Wnt信号通路相关的基因,如Wnt10b、Ccn4、Wnt9a、Fzd4、Fzd7、Sox9、Lzts2和Dkk3,在Sham组和TAC组的GFP+的成纤维细胞中均被上调。综合RNA-seq的数据,研究人员认为,TAC损伤后,EndoFb相较于心脏中其他成纤维细胞亚群处于一种更活化的状态,且具有更活跃的增殖信号通路和Wnt信号通路基因的活化。
为了在EndoFb中特异性敲除Wnt信号通路,研究人员构建了Nfatc1-Dre;Col1a2-RSR-CreER;Ctnnb1-flox小鼠(Ctnnb1-KO系统)。在这种设计中,Nfatc1-Dre中的Dre切除掉Col1a2-RSR-CreER中的rox-Stop-rox,将其变成Col1a2-CreER等位基因,CreER在Tam的作用下切除Ctnnb1-flox中的Exon1-4,从而实现仅在心内膜来源的成纤维细胞中敲除Ctnnb1。为了同时追踪EndoFb并敲除EndoFb中的Ctnnb1,研究人员将Ctnnb1-KO系统与R26-RL-GFP交配,获得Nfatc1-Dre;Col1a2-RSR-CreER;R26-RL-GFP;Ctnnb1-fl小鼠,并将其作为突变体小鼠,同时将它们的同窝小鼠Nfatc1-Dre;Col1a2-RSR-CreER;R26-RL-GFP;Ctnnb1-wt作为对照,用于TAC后的分析。对TAC后28天的对照组小鼠心脏和突变体小鼠心脏进行组织学分析,结果表明,与对照组小鼠相比,突变体小鼠心脏中纤维化程度减轻,心脏肥大水平下降,心肌细胞大小更接近野生型小鼠。对照组小鼠和突变体小鼠进行心脏功能连续监测数据显示突变体小鼠心脏功能下降趋势相较于对照组小鼠明显减缓。这些数据表明,在EndoFb中特异性敲除Ctnnb1能明显减少TAC所导致的心脏纤维化,并能保护心脏功能。
以上研究揭示了先前一直未受重视的起源于心内膜的独特成纤维细胞亚群(EndoFb),发现该亚群的成纤维细胞在心脏纤维化病理过程中具有重要的调节功能,为未来心脏疾病的治疗提供了一个新的潜在靶点。该研究也展示了使用双重组酶介导的遗传谱系示踪技术对于研究体内某个细胞亚群在特定疾病发展过程中的机制和功能的优势,为研究亚群细胞对多种疾病的发生发展提供新的思路。
该项工作在分子细胞卓越中心周斌研究员的指导下,由博士生韩茂莹,刘子鑫和刘磊等共同完成。感谢瑞典阿斯利康公司生物制药研发部Qing-Dong Wang研究员,南京医科大学心血管疾病转化医学协同创新中心季勇教授,美国德克萨斯州休斯顿市贝勒医学院医学部心脏病科Reza Ardehali教授,浙江大学附属儿童医院小儿心血管外科舒强教授,香港中文大学Kathy O. Lui教授,复旦大学附属中山医院血管外科王利新教授等对本研究的大力支持。感谢分子细胞卓越中心动物平台和细胞分析技术平台对本研究的大力支持。感谢中科院、基金委、科技部以及上海市科委等部门的经费支持。
文章链接: https://www.nature.com/articles/s41588-023-01337-7
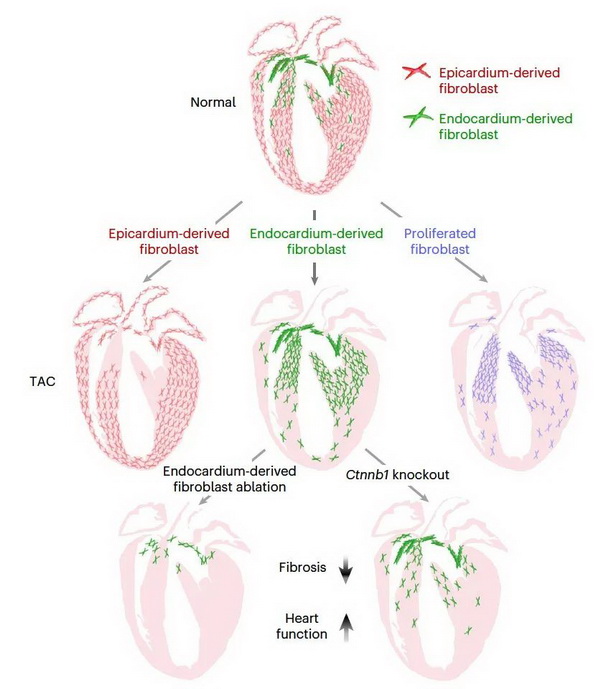
靶向EndoFb可减缓心脏纤维化和心功能衰竭
注:EndoFb在心脏中呈区域性分布。在压力负荷诱导的损伤后,EndoFb在纤维化区发生高度区域性增殖。EndoFb的遗传清除或敲除EndoFb中的Wnt信号通路可明显减少其扩张,减轻心脏纤维化的严重程度,并减缓心脏功能下降的进程。