3月30日,国际学术期刊PNAS在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)汪胜研究组和丛尧研究组的合作研究成果:“Structural insights into constitutive activity of 5-HT6 receptor“。该研究通过解析血清素受体5-HT6-Gs复合物的结构,揭示了5-HT6受体不依赖于配体的高水平组成性活性的决定性因素,阐明5-HT6受体高组成性活性的分子机制,并以结构为导向设计受体特异性纳米抗体NB6A1,为帮助理解G蛋白偶联受体(GPCR)组成性活性的理论机制提供重要信息。
血清素是一种重要的神经递质,在调节情感、认知、学习、记忆、疼痛等一系列生理活动中起着至关重要的作用。血清素通过作用于血清素受体发挥功能。人体内的血清素受体一般7个家族(5-HT1-7)13种亚型,除了5-HT3是配体门控离子通道外,其余都是具有7次跨膜螺旋结构的GPCR。与大多数血清素受体不同,5-HT6受体仅分布在中枢神经系统中,靶向该受体已被证明在治疗阿尔兹海默症、精神分裂症等神经精神疾病起到重要作用。此外,5-HT6受体表现出的不依赖于配体的高水平组成性活性,与神经元发育、新皮层径向迁移和人神经干细胞的自我更新有关。众所周知,大多数受体均具有不同程度的不依赖于其配体的组成性活性,然而这种组成性活性的确切机制仍未知。
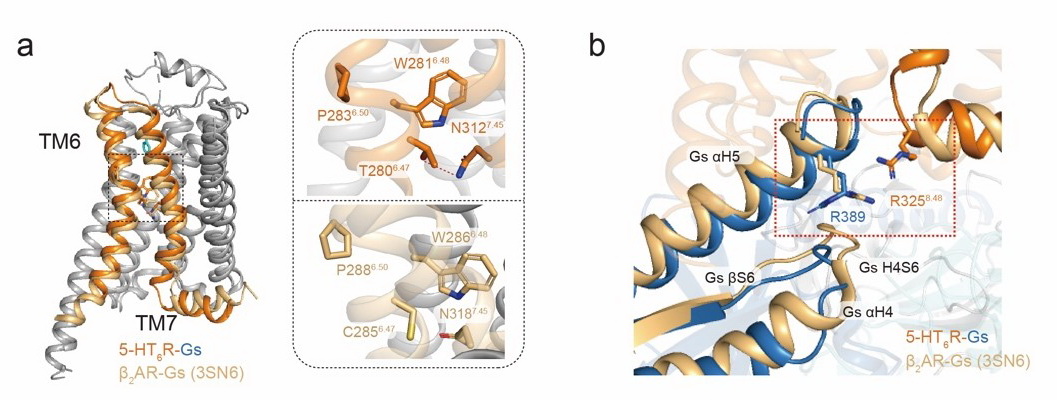
在本项研究中,研究人员利用冷冻电镜技术,成功解析了血清素激活5-HT6受体与Gs蛋白形成复合物的高分辨率冷冻电镜结构。基于结构的解析,通过体外功能性实验,揭示了5-HT6受体不依赖于配体高组成性活性的结构决定因素:即钠离子结合口袋的破坏和G蛋白α亚基与受体的高效解离。
研究组的前期工作(Science,2017)和同期的系列研究表明,GPCR普遍存在钠离子结合位点,并且该结合位点在整个A类GPCR中高度保守。钠离子与GPCR的结合一直以来被认为是维持受体处于非激活状态的关键因子。而在该项工作中的高分辨率冷冻电镜结构表明,5-HT6受体第280位的苏氨酸和第312位的天冬氨酸之间形成的氢键破坏了钠离子结合口袋,影响了5-HT6受体与钠离子的结合,使得受体更易于处于激活状态;另一方面,GPCR激活后,G蛋白α亚基和βγ亚基分离,并进一步与受体解离,完成整个受体的激活过程。5-HT6受体第325位的精氨酸和G蛋白α亚基第378位的精氨酸之间产生的同电荷互斥作用,使得G蛋白α亚基能够快速从受体中解离,进而高效完成受体介导的下游信号激活过程。上述两方面因素的协同作用,维持了5-HT6受体的高组成性活性。基于以上结构特征,汪胜研究组设计并筛选出5-HT6受体特异性结合的纳米抗体-NB6A1,通过体外功能实验验证了其能显著降低受体组成性活性,进一步确认了5-HT6受体组成性活性的结构基础,为后续理解GPCR组成性活性的理论机制提供重要信息。
分子细胞卓越中心汪胜研究员与丛尧研究员为本文共同通讯作者,汪胜研究组博士研究生贺莉聪、祁建忠与丛尧研究组博士研究生赵巧钰、汪一帆为本文共同第一作者。感谢国家蛋白质科学研究(上海)设施冷冻电镜系统、数据库与计算分析系统的大力支持。该研究工作得到科技部、国家自然科学基金、中国科学院和上海市科委等经费支持。
文章链接:https://doi.org/10.1073/pnas.2209917120
5-HT6受体高组成性活性的结构决定因素