7月4日,国际学术期刊PNAS在线发表了中国科学院分子细胞科学卓越创新中心许琛琦研究组、中国科学院生物物理研究所娄继忠课题组以及浙江大学医学院陈伟课题组合作完成的最新研究成果 “Self-programmed dynamics of T cell receptor condensation”。该工作发现了T细胞受体(TCR)通过内置的基于CD3ε/Lck的一套自编程的聚集以及解聚的机制来调控T细胞激活,从相分离的角度阐释了TCR信号通路敏感性以及快速性的分子机制,并且进一步丰富了TCR基于Csk的负调控机制。
T细胞是适应性免疫的重要组成部分,TCR复合体作为T细胞膜表面最关键的膜受体,可以识别抗原并介导T细胞激活。TCR复合体有4种CD3信号链(CD3g/d/e/z),共携带20个酪氨酸位点。不同的抗原刺激会引起不同的磷酸化模式,从而产生不同的免疫应答。许琛琦研究团队一直致力于T细胞的信号转导及功能调控研究。团队前期研究发现,在静息状态时,CD3e链和CD3z链的碱性氨基酸富集区(BRS)通过和细胞膜上酸性磷脂发生静电作用,使得ITAM基序被保护起来,免于被下游激酶磷酸化(Cell 2008)。T细胞活化初期,内流的Ca2+通过中和酸性磷脂所带的负电荷,帮助TCR复合物的胞内段从细胞膜上解离下来,从而发生磷酸化(Nature 2013)。酪氨酸激酶Lck具有明显的底物选择性,其UD结构域和CD3e链胞内区的BRS序列发生静电相互作用,从而高效介导磷酸化过程(PNAS 2017)。而磷酸化的CD3e链可以通过其ITAM信号基序招募抑制性激酶Csk来负向调控TCR信号强度,使TCR信号能够维持在合适水平(Cell 2020)。
在该项最新研究中,研究人员利用体外重组二维膜系统(SLB)对TCR的四种CD3亚基胞内域进行了筛选,发现只有CD3ε亚基的胞内域可以与Lck在二维膜上发生相分离。CD3ε亚基胞内域的BRS序列以及Lck的UD结构域对于两者的相分离十分重要。研究者们通过体外重组液滴以及细胞激活实验,发现相分离不仅增强了CD3ε以及CD3ζ胞内域的磷酸化,而且进一步促进了Lck的激活,这种自我促进的相分离系统可以帮助T细胞仅凭少量的TCR激活即可快速活化。结合前期数据,研究人员发现磷酸化的CD3ε可以招募抑制性激酶 Csk,Csk的竞争性结合导致Lck被排出CD3e/Lck相分离。同时,Csk还可以使活化的Lck回到非活化状态,进而抑制T细胞的过度活化。
生物物理所博士研究生陈辉、分子细胞卓越中心博士研究生徐心怡及浙大医学院第一附属医院肾脏病中心特聘研究员胡炜为本文的共同第一作者;许琛琦研究员、娄继忠研究员及陈伟教授为共同通讯作者;哈尔滨医科大学肿瘤医院娄长杰主任、清华大学刘万里教授以及美国宾夕法尼亚大学姜宁教授也在本项研究中做出了重要贡献。相关荧光成像工作在中国科学院生物物理所生物成像中心完成,该研究工作得到自然科学基金、中国科学院战略性先导科技专项项目(B类)、国家重点研发项目等基金的资助。
文章链接:https://doi.org/10.1073/pnas.2217301120
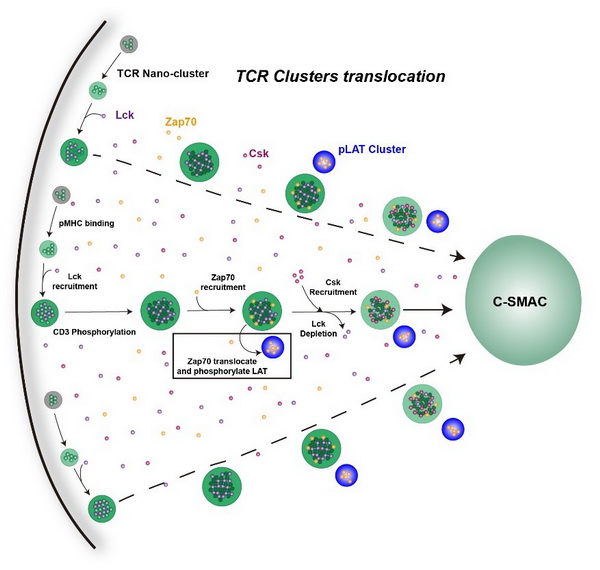
TCR/Lck相分离介导TCR信号转导的模式图