7月7日,国际学术期刊Journal of Biological Chemistry在线发表了中国科学院分子细胞科学卓越创新中心胡红雨研究组的最新研究“PABPN1 aggregation is driven by Ala expansion and poly(A)-RNA binding, leading to CFIm25 sequestration that impairs alternative polyadenylation”。该工作揭示了丙氨酸延伸和poly(A)-RNA结合是核多聚腺苷酸结合蛋白PABPN1发生相变和积聚的重要因素,并且PABPN1积聚物通过募集3’-UTR加工复合物中的组分CFIm25进而影响mRNA的可变多聚腺苷酸化功能。
蛋白质发生淀粉样积聚是各种神经退行性疾病的共同病理特征,这些蛋白质积聚有很大一部分是由于基因组上的三核苷酸重复序列延伸突变所导致的,例如引起亨廷顿舞蹈症的亨廷顿蛋白,其序列中通常包含有几十个连续的谷氨酰胺重复序列 (polyQ)。另外,还有一大类是由RNA结合蛋白突变所引起的,如与肌萎缩性侧索硬化症 (ALS) 相关的蛋白TDP-43, FUS蛋白等。在真核细胞中,有一类重要的RNA结合蛋白负责结合mRNA的poly(A)尾,在mRNA的运输、翻译以及稳定性过程中起到关键作用。PABPN1是一个定位于细胞核内的poly(A)结合蛋白,以前的研究表明,野生型的PABPN1可以在mRNA的帮助下定位到细胞核内的核斑点 (Nuclear Speckles)中,参与和控制poly(A)尾的合成。野生型PABPN1的N-端含有一段由10个丙氨酸组成的重复序列,丙氨酸延伸的PABPN1可以在细胞核内形成积聚物,并引起肌肉退行性疾病——咽眼部肌肉萎缩症(OPMD)的发生。有关PABPN1的积聚和募集作用以及致病性是值得深入探讨的科学问题。
在该研究中,研究人员通过生化实验和细胞免疫荧光实验,以及体外相分离实验证实,PABPN1可以通过mRNA的poly(A)尾介导发生液-液相分离而形成动态的核斑点结构。在这个过程中丙氨酸重复序列的长度控制着PABPN1核斑点的动态性,丙氨酸延伸导致PABPN1发生相变,由动态的核斑点转变为固相积聚物 (Aggregates)。进一步研究发现,PABPN1积聚物可以通过序列特异性的mRNA来募集3’-UTR加工复合物中的重要组分CFIm25,使得可溶性的CFIm25被隔离到PABPN1的积聚物中,引起CFIm25正常功能的缺失,进而影响到下游靶基因的可变多聚腺苷酸化过程。这项工作揭示了PABPN1积聚和募集作用的分子机制,对于进一步理解蛋白质积聚致病的病理机制具有重要意义。
分子细胞卓越中心博士研究生关文亮为本文第一作者,胡红雨研究员为该论文通讯作者。感谢分子细胞卓越中心细胞分析技术平台的大力支持。该工作得到国家科技部、国家自然科学基金委和中国科学院项目经费资助。
文章链接:https://www.sciencedirect.com/science/article/pii/S0021925823020471
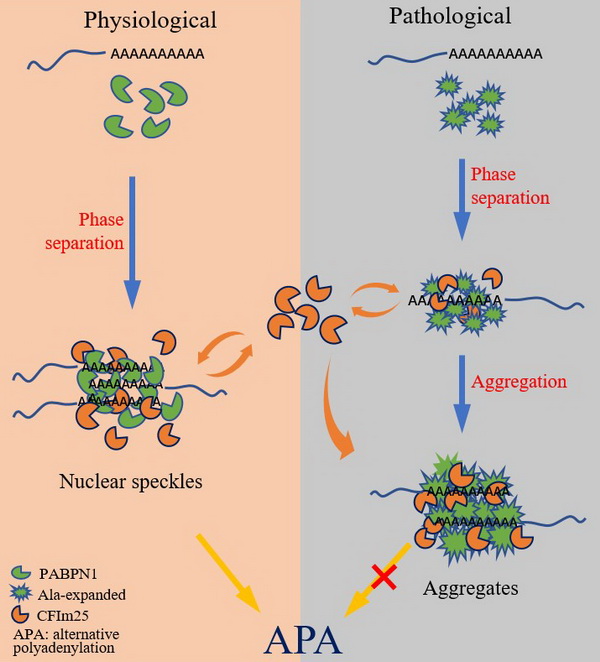
PABPN1的积聚和募集作用及致病的分子机制。丙氨酸重复序列和poly(A)-RNA共同调节PABPN1的相分离和积聚的相变过程。丙氨酸延伸导致PABPN1形成固相的积聚物并募集CFIm25蛋白,减少了CFIm25分子的可利用率而使其正常功能缺失,进而影响细胞中可变多聚腺苷酸化的过程。