8月2日,国际学术期刊Science Bulletin在线发表了中国科学院分子细胞科学卓越创新中心 (生物化学与细胞生物学研究所) 周小龙研究组与王恩多研究组最新合作研究成果 “Mitochondrial RNA m3C methyltransferase METTL8 relies on an isoform-specific N-terminal extension and modifies multiple heterogenous tRNAs”。
tRNA是mRNA翻译中的关键接头分子。tRNA上存在着大量的转录后修饰,调控蛋白质合成的速度与保真性。3-甲基胞嘧啶(m3C) 修饰广泛存在于真核生物的多种细胞质与线粒体tRNA反密码子环第32位。
研究组前期研究发现,人细胞质tRNA第32位的m3C (m3C32) 修饰由METTL2A/2B和METTL6介导,而人线粒体tRNAThr (hmtRNAThr)和tRNASer(UCN) (hmtRNASer(UCN)) 的m3C32修饰由METTL8催化;人METTL8通过mRNA可变剪接,产生长短不同的两种蛋白质同源异形体。长形式的METTL8-Iso1进入线粒体催化hmtRNAThr和hmtRNASer(UCN)的m3C32修饰;而短形式的METTL8-Iso4分布在核仁,功能未知。METTL8-Iso1仅比METTL8-Iso4多出一段长度为28个氨基酸的N-端延伸肽段,主体结构完全一致,也含有甲基化活性中心。METTL8-Iso4是否具有m3C32甲基转移酶活性以及METTL8-Iso1中的N-端延伸在线粒体tRNA m3C32修饰中的作用并不清楚;细胞质或线粒体m3C32修饰酶能否交叉识别不同细胞区室的tRNA也尚不清楚。此外,由于绝大多数tRNA m3C32修饰需要反密码子环第37位腺嘌呤N6-苏氨酰基甲腺苷酸(t6A37)修饰作为先决条件,制备只含有m3C32修饰的tRNA分子尚不能实现。
针对以上科学问题,研究人员通过序列比对,确定了METTL8-Iso1的N-端延伸的保守性;通过一系列体外酶活实验揭示METTL8-Iso4不具备m3C32修饰活力;进一步通过体外与体内遗传学实验证明,METTL8-Iso1的N-端延伸在催化过程中,作为关键的tRNA结合元件发挥作用,并进一步鉴定了其中的2个完全保守的氨基酸残基在所有的METTL2A/2B/8类蛋白质中的功能保守性;通过不同细胞区室m3C32修饰酶的交叉识别研究,发现线粒体m3C32修饰酶METTL8-Iso1对细胞质及大肠杆菌tRNA都具备明显的修饰活力,且常不依赖于t6A37作为修饰的先决条件,而细胞质m3C32修饰酶METTL2A和METTL6却无法催化线粒体tRNA的m3C32修饰,说明了METTL8-Iso1具有更加宽松的底物识别特性;m3C32修饰并不影响hmtRNAThr t6A37修饰水平及其氨基酰化;最后,研究还揭示METTL8-Iso1分别与线粒体丝氨酰-tRNA合成酶(SARS2) 及线粒体苏氨酰-tRNA合成酶(TARS2)相互作用并显著促进SARS2和TARS2的氨基酰化活力。
该项工作揭示了METTL8通过特定的N-端延伸作为关键的RNA结合元件介导线粒体tRNA修饰的分子机制;发现了METTL8具有广谱的tRNA识别特性,为位点特异性制备只含有m3C修饰组分的RNA提供了基础;为全面认识细胞质和线粒体tRNA m3C修饰机制的保守型与差异性提供了视角。
分子细胞卓越中心博士研究生黄梦涵为该文第一作者,周小龙研究员和王恩多研究员为本文共同通讯作者。海南大学林桓副教授参与研究。该研究得到分子细胞卓越中心分子生物学技术平台支持。感谢科技部国家重点研发计划、基金委、中国科学院、上海市的经费资助。
文章链接:https://www.sciencedirect.com/science/article/pii/S2095927323005170
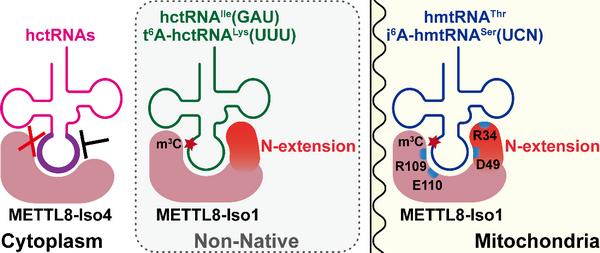
METTL8-Iso1依赖N-端延伸识别并催化天然和非天然底物tRNA的m3C32修饰