8月29日,国际学术期刊Nature Communications在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)吴立刚研究组与南京医科大学李建民研究组合作的最新研究成果“The non-redundant functions of PIWI family proteins in gametogenesis in golden hamsters”。该研究以金黄地鼠(Mesocricetus auratus,golden hamster)为动物模型,全面揭示了PIWI家族成员及其结合的piRNA在配子发生和早期胚胎发生中非冗余的调控功能,为研究哺乳动物piRNA功能奠定了重要基础。
piRNA(PIWI-interacting RNA)是一类生殖细胞特异表达的非编码小RNA,与PIWI蛋白形成效应复合体,参与转座子沉默和基因表达调控,在配子发生和受精卵发育过程中发挥广泛而重要的功能。以往对哺乳动物PIWI/piRNA的功能认识主要基于小鼠模型。然而,研究组前期研究表明小鼠卵细胞中非编码小RNA的组成在哺乳动物中不具有广泛代表性,并首次在人和食蟹猴卵细胞中发现新的piRNA家族成员os-piRNA(2019,Nature communication)。近期包括该研究组在内的三项独立研究表明,piRNA通路重要作用蛋白PIWIL1和MOV10L1(RNA解旋酶)的缺失均可导致金黄地鼠雌雄不育,与小鼠中表型有着明显的差别(2021,Nature Cell Biology)。以上研究证明了小鼠并不是研究哺乳动物雌性生殖细胞发育中piRNA功能的最佳动物模型,以往通过小鼠建立的哺乳动物piRNA经典结论需要在更加具有代表性的金黄地鼠中重新研究或加以确认。
针对上述科学问题,研究人员分别制备和获得了四种PIWI蛋白的特异性抗体,结合超分辨共聚焦显微技术,全面分析了四种PIWI亚家族蛋白在金黄地鼠精子发生、卵子发生和早期胚胎发育中的时空表达特征,同时结合高通量测序技术细致地描绘了不同发育时期中PIWI蛋白所结合的piRNA表达谱。随后,研究人员利用CRISPR技术分别构建了四种PIWI缺失的金黄地鼠突变系,研究了不同PIWI蛋白突变所引发的生殖缺陷表型。结果表明,PIWIL1同时在雌性和雄性生殖细胞及早期胚胎中高表达,主要结合29-30 nt piRNA,突变后导致雌雄均不可育:突变的生精细胞在进入双线期前发生大量死亡,部分可进入双线期的生精细胞随后发育停滞,而突变的卵母细胞可正常发育,但受精后胚胎发育停滞于2细胞时期。PIWIL2和PIWIL4主要在生精细胞中表达,但两者表达存在明显的时期特异性,且分别结合27 nt或28 nt piRNA。PIWIL2或PIWIL4突变后生精过程严重受阻,大量精原细胞凋亡,造成雄性不育。PIWIL3高表达于卵母细胞和早期胚胎中,结合19 nt的os-piRNA,突变后卵母细胞发育正常,但受精后的胚胎发育迟缓,且大部分在发育过程中停滞或凋亡,最终导致生育能力显著下降。
研究发现PIWI蛋白功能存在明确的分工但又紧密联系。在卵母细胞发育中,PIWIL1/piRNA可以代偿PIWIL3/piRNA活性,抑制以LINE/L1和LTR/ERVK为主的活跃转座子的表达,反之则不然。而在生精细胞发育过程中,PIWIL4入核功能及其相关piRNA的加工依赖于PIWIL2,两者协同完成转座子的转录水平和转录后水平沉默。
综上,本研究使用更具代表性的金黄地鼠作为模型,全面绘制了PIWI家族各个成员在配子发生和早期胚胎发育中的时空表达谱,构建并比较了四种PIWI突变体的生育表型和分子表型,发现四种PIWI蛋白在配子发生和早期胚胎发育中具有非冗余的调控作用,为piRNA通路异常与人类生殖相关疾病的诊治提供了重要理论基础和动物模型。
分子细胞卓越中心吴立刚研究员和南京医科大学李建民教授及施爱民教授为该论文的共同通讯作者,分子细胞卓越中心博士后吕小龙、博士肖稳和博士后张宏道、南京医科大学赖娅娜和硕士张肇真为该论文的共同第一作者。该研究得到分子细胞卓越中心刘默芳研究员和童明汉研究员、实验动物技术平台以及信息化管理团队的大力支持。感谢国家自然科学基金委、科技部、中国科学院、上海市和江苏省的经费支持。
文章链接:https://www.nature.com/articles/s41467-023-40650-x
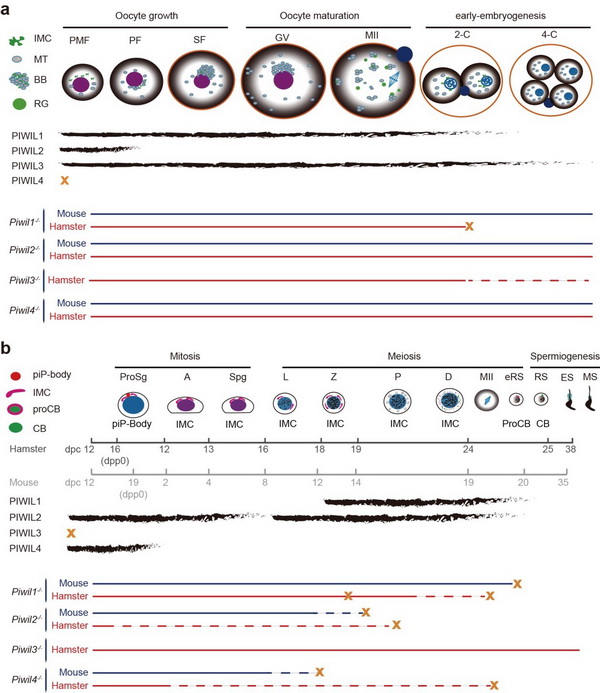
PIWI蛋白表达及突变后表型示意图