12月15日,国际学术期刊Journal of Clinical Investigation在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)李振斐研究组、同济大学附属同济医院吴登龙团队和中国科学院上海营养与健康研究所李昕研究组的共同研究成果“Active DHEA uptake in the prostate gland correlates with aggressive prostate cancer”。该工作探索了适用于我国人群的恶性前列腺癌早期防治新策略。
恶性前列腺癌的早期预测是前列腺癌精准治疗的基础,也是领域内难点问题。传统的临床诊断方法难以满足精准诊断的需求。新近开发的基于差异表达基因的诊断方法(例如Decipher)无法为后续疾病干预提供新靶点和新策略。同时,前列腺癌存在明显的种族异质性,基于西方人群开发的疾病精准诊断方法对我国人群的适用性尚不明确。开发适用于我国人群的早期前列腺癌恶性演进趋势预测方法及对应的临床干预策略意义重大。
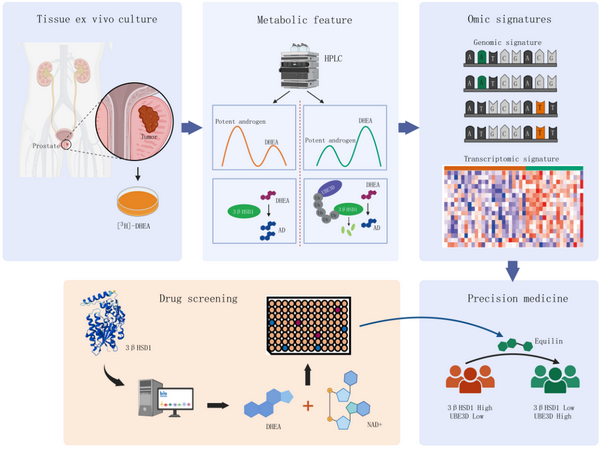
支持早期前列腺癌发生发展的雄激素主要源于睾丸和肾上腺。研究组前期发现我国人群SRD5A活性较低(Cell Rep Med,2022),并联合复旦大学代谢研究院任若冰教授阐明了我国人群SRD5A低酶活的结构基础(Nat Commun,2021)。SRD5A是前列腺利用睾丸来源的睾酮合成双氢睾酮的关键代谢酶。因此,研究团队提出,肾上腺来源的雄激素对我国患者疾病早期进展意义重大。代谢酶3bHSD1是该过程的限速酶。3bHSD1活性高的腺体有可能更容易孕育恶性前列腺癌。
为了衡量患者前列腺组织内部代谢酶3bHSD1活性,研究团队利用[3H]-DHEA处理患者新鲜穿刺组织,通过示踪组织内雄激素代谢进程来计算组织内代谢酶3bHSD1活性。进而结合三个临床队列发现代谢酶3bHSD1活性高的患者更多出现在前列腺癌患者(与健康人群对比)、初诊转移癌患者(与原位癌患者相比)和治疗耐受患者群体中,初步建立了组织代谢酶活性与疾病恶性演进的相关性。
为了进一步开发有临床应用前景的诊断方法,研究团队利用3bHSD1活性不同的穿刺组织进行了多组学测序,结合UKB、TCGA等数据库建立了能够指征3bHSD1酶活、反应疾病恶性演进趋势的多种指纹特征,包括利用患者血液检测的遗传变异指纹(GWAS signature)和利用患者穿刺组织检测的转录组指纹(transcriptomic signature)。研究团队在CPGEA等数据库中确认了相应指纹与前列腺癌发生、恶性演进的相关性。
研究团队同时揭示了我国人群3bHSD酶活个体异质性根源。泛素连接酶AMFR之前被报道参与了西方人群3bHSD1酶活异质性的调节。然而该基因与我国患者组织代谢酶活性未现相关性。研究团队发现泛素连接酶UBE3D丰度与我国患者3bHSD1活性呈负相关,并且在多个数据库中与前列腺癌恶性演进呈负相关。进一步机制研究发现,UBE3D通过泛素化修饰3bHSD1调节其蛋白质稳定性且修饰位点不同于AMFR。
研究团队进一步建立靶向代谢酶3bHSD1的小分子筛选系统,并且发现equillin是3bHSD1强效抑制剂。Equilin能够直接结合并抑制3bHSD1酶活,进而抑制雄激素合成,在多个研究模型中展示了拮抗前列腺癌进展的能力。新3bHSD1抑制剂的发现为恶性前列腺癌高风险人群的疾病早期干预提供潜在的治疗策略。
综上,研究团队结合临床队列发现了高3bHSD1酶活是恶性前列腺癌早期发生发展的代谢特征,结合多组学数据和算法开发获得了具有临床应用潜力的恶性前列腺癌早诊方法,结合药物筛选系统提出恶性前列腺癌预防或早期干预的潜在策略。
分子细胞卓越中心张学彬、何东印,中国科学院上海营养与健康研究所王增明,同济大学附属同济医院黄盛松为本论文共同第一作者。分子细胞卓越中心李振斐研究员、同济大学附属同济医院吴登龙主任医师和中国科学院上海营养与健康研究所李昕研究员为该论文共同通讯作者。该项工作得到了科技部“前沿生物技术” 重点专项、中国科学院先导计划、基金委“糖脂代谢的时空网络调控”重大研究计划等项目的支持。李振斐研究组长期关注机体代谢和前列腺癌种族异质性研究,欢迎对转化医学感兴趣的博士后加盟。
文章链接:https://www.jci.org/articles/view/171199#SEC5
早期前列腺癌恶性演进的预测和防治