2月22日,国际学术期刊Cancer Cell在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)季红斌研究组联合纽约大学医学院Kwok-Kin Wong团队,哈佛医学院丹娜法伯癌症研究院Andrew J. Aguirre团队以及清华大学张奇伟团队的合作研究成果:“Adeno-to-squamous transition drives resistance to KRAS inhibition in LKB1-mutant lung cancer”。该研究通过整合性地分析KRAS突变靶向治疗的临床数据及KRAS突变肺癌小鼠模型和类器官模型,发现肺腺鳞癌转分化能够驱动KRAS突变靶向治疗耐药,而KRT6A分子可以预测患者对KRAS靶向治疗的应答。
KRAS突变是临床上肺腺癌中最为常见的致癌基因之一,因KRAS“不可成药靶点”的特征,长期以来针对KRAS突变的靶向治疗一直是肿瘤研究领域备受关注的问题之一。自2021年以来,两个获FDA批准用于靶向KRASG12C突变的抑制剂(Sotorasib和Adagrasib)在肺癌、胰腺癌和结直肠癌中显示出令人鼓舞的治疗效果,为靶向KRAS突变带来了曙光。此外,靶向KRASG12D突变的抑制剂MRTX1133也在临床试验之中。随着临床试验的深入开展,耐药性的问题也随之出现。目前已有报道提示肿瘤细胞可以通过产生新的基因突变或者激活代偿通路使得RAS通路重新激活,从而获得对KRAS抑制剂的耐药性。研究还发现代谢重编程或上皮间充质转变(epithelial-to-mesenchymal transition)也在KRAS抑制剂耐药发生过程中发挥着重要作用。由于药物治疗过程中不同患者的耐药机制各不相同,因此,揭示新的KRAS抑制剂耐药机制并鉴定药物响应相关的生物学标志物至关重要。
肿瘤表型可塑性是导致靶向治疗耐药的重要机制之一,已经被列为新的cancer hallmark(Hanahan et al., Cancer Discov 2022)。比如,EGFR突变肺腺癌患者在三代靶向治疗药物奥西替尼耐药后,大约7-9%的患者在二次活检时表现出肺鳞癌的病理学特征(Schoenfeld et al., Clin Cancer Res 2020)。在KRAS抑制剂Adagrasib的临床试验(KRYSTAL-1)中,哈佛医学院丹娜法伯癌症研究院的Andrew J. Aguirre团队发现9例肺腺癌耐药患者中就有2例患者的再活检样本表现出肺鳞癌的病理学特征(Awad et al., NEJM 2021)。这提示肺腺鳞癌转分化(adeno-to-squamous transition, AST)可能与KRAS抑制剂耐药具有潜在关联。季红斌研究组长期致力于肺腺鳞癌转分化模型的建立和分子机制研究,发现LKB1基因失活会导致肺腺鳞癌转分化(Ji et al., Nature 2007;Han et al., Nat Commun 2014),揭示氧化应激通路、WNT通路以及转录因子YAP等在该过程中发挥着重要作用( Li et al., Cancer Cell 2015;Fang et al., STTT 2023;Gao et al., Nat Commun 2014)。但是,很多问题还有待深入研究,比如肺腺鳞癌转分化是否是导致KRAS抑制剂耐药的元凶之一?如果是的话,肺腺鳞癌转分化是如何影响KRAS抑制剂耐药的?
该研究通过整合性分析68例参与KRYSTAL-1临床试验的KRASG12C突变非小细胞肺癌患者在Adagrasib治疗前的转录组数据及患者进行Adagrasib治疗持续时间 (treatment duration)、无进展生存期和总生存期数据,发现富集鳞癌相关特征的患者往往具有更短的治疗持续时间,而这一现象只存在于LKB1突变的非小细胞肺癌患者亚群中。研究人员构建了KRASG12C/Lkb1和KRASG12C/Trp53肺腺癌小鼠模型并进行KRAS抑制剂处理,发现只有在发生耐药的KRASG12C/Lkb1突变小鼠模型中能够观察到肺腺鳞癌转分化的发生,提示Lkb1基因缺失确实在驱动肺腺鳞癌转分化中发挥着重要作用。这一点也进一步在KRASG12C/Lkb1及KrasG12D/Lkb1小鼠肺腺癌来源的类器官研究中得到证实。通过深入分析KrasG12D/Lkb1小鼠肺腺癌来源的类器官模型,研究人员发现只有一半左右的类器官具备腺鳞癌转分化的潜能 (plastic ADC organoids);相比于不具备腺鳞癌转分化潜能的类器官,这些类器官对KRAS抑制剂处理不敏感。类器官样本的转录组学和表观组学整合性分析发现,ELF5作为在肺腺癌中特异性表达的转录因子可促进肿瘤细胞对KRAS抑制剂的响应;此外,ELF5还可以与鳞癌谱系转录因子ΔNp63的增强子C40结合来抑制其基因表达。随着ELF5基因表达在腺鳞癌转分化过程中下降,ΔNp63基因表达会逐渐上调从而驱动腺鳞癌转分化的发生并促进肿瘤细胞对KRAS抑制剂的耐药。
研究人员通过收集时序连续的肺腺鳞癌转分化小鼠类器官样本进行单细胞转录组分析,发现在腺鳞癌转分化过程中出现了一个具有高可塑性细胞状态(High-plasticity cell state, HPCS)的过渡亚群。通过整合分析KRAS靶向治疗耐药的小鼠肺癌以及HPCS过渡亚群的转录组数据,研究人员进一步确定了包含KRT6A在内的六个基因并将其定义为腺鳞癌转分化可塑性信号(AST plasticity signature),而该信号在腺鳞癌转分化及KRAS靶向治疗耐药过程中呈现富集。这一发现进一步得到KRYSTAL-1临床数据的支持。在临床KRAS靶向治疗中,富集腺鳞癌转分化可塑性信号的肺癌患者具有较短的Adagrasib治疗持续时间。更为重要的是,高表达KRT6A的患者往往具有更短的药物治疗持续时间、无进展生存期和总生存期。
该研究从临床现象出发,利用小鼠模型和类器官模型进行深入的功能和机制分析,再回到临床,是典型的Bedside-to-Bench-to-Bedside 癌症研究范式。该研究不仅仅证实了肺腺鳞癌转分化导致KRAS靶向治疗耐药的假说,而且在深入揭示谱系转录因子介导耐药的分子机制基础上,提出KRT6A作为临床KRAS靶向治疗不良预后的生物学标志物。
分子细胞卓越中心童欣媛博士,纽约大学医学院Ayushi S. Patel博士研究生,哈佛医学院丹娜法伯癌症研究院Eejung Kim博士以及清华大学李洪军博士为该文的共同第一作者。分子细胞卓越中心季红斌研究员,纽约大学医学院Kwok-Kin Wong教授,哈佛医学院丹娜法伯癌症研究院Andrew J. Aguirre教授以及清华大学张奇伟教授为该文的共同通讯作者。该研究得到分子细胞卓越中心高栋研究员在类器官培养方面的悉心指导和帮助,还得到陈洛南研究员、中国医学科学院/北京协和医学院陈阳研究员、Mirati公司James G. Christensen和Peter Olson博士的大力支持和帮助。该研究得到国家重点研发计划、国家自然科学基金、中国科学院基础前沿科学研究计划等项目的资助,并获得分子细胞卓越中心分子生物学技术平台、细胞分析技术平台、化学生物学技术平台和动物实验技术平台的帮助与支持。
文章链接:https://www.sciencedirect.com/science/article/pii/S1535610824000369
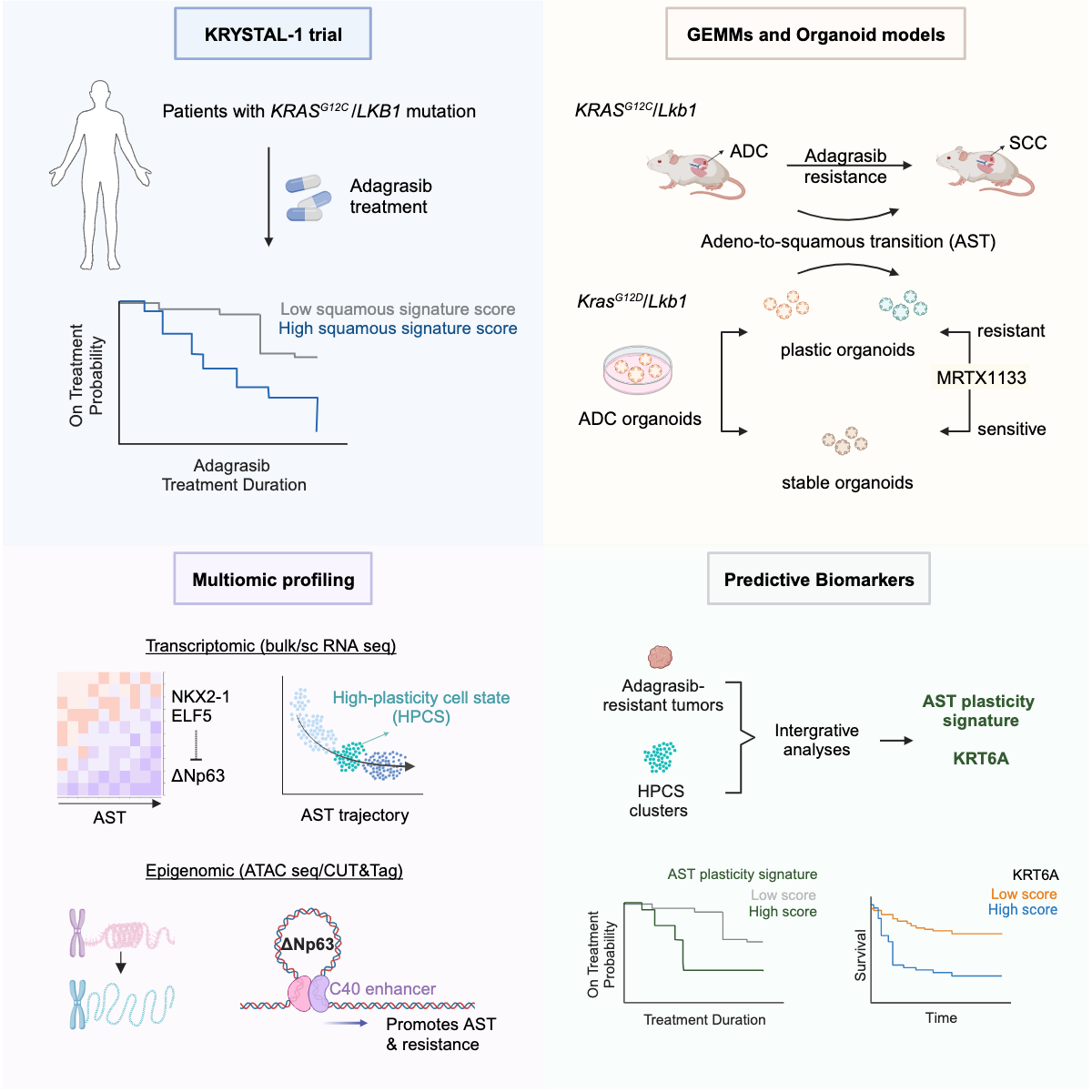
腺鳞癌转分化驱动KRAS抑制剂耐药研究的图解摘要