3月5日,国际学术期刊Immunity在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周波课题组,联合中国科学院北京基因组研究所(国家生物信息中心)王前飞课题组和中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛课题组的合作研究成果:“Differentiation route determines the functional outputs of adult megakaryopoiesis”。该研究开发了新型谱系示踪系统,结合单细胞测序,对造血干细胞(HSC)的分化路径与巨核细胞(MK)产量和功能之间的关系进行解析。
越来越多的研究表明,提出HSCs(或MPPs)可以直接分化为巨核系祖细胞MkPs,而无需经历经典造血等级中一系列的限制性祖细胞(restricted progenitors, RPs)阶段,那么为什么HSC或MPPs在可以直接分化为巨核谱系的情况下还没有舍弃经过一系列RPs的逐步分化路径呢?受技术限制,一直以来人们很难对两种分化路径进行比较,不同分化路径产生MkPs和MKs的分化动力学也仍不清楚。
研究人员首先开发了可以区分直接(direct)和逐步(stepwise)造血分化路径的谱系示踪系统,CD48-Dre实现了对逐步分化路径上的RPs的高效且特异性的标记,同时,研究组构建了Rosa26loxp-STOP-loxp-rox-loxp-ZsGreen-STOP-rox-tdTomato (R26ZT1) 报告小鼠,利用此小鼠将广泛表达的Ubc-creER与CD48-Dre正交重组,实现了对CD48-Dre+细胞的诱导性示踪,绘制了不同谱系各个层级造血细胞的更替曲线,结果提示逐步分化路径上的全部祖细胞都在示踪开始后快速且完全地被更替。利用仅在造血干祖细胞,不在成熟血细胞中表达的Kit-creER与CD48-Dre正交重组,团队又绘制了不同分化路径上各种造血祖细胞产生下游成熟细胞的分化动力学曲线,并发现两种分化路径在稳态下对巨核细胞的贡献具有相当的数量和相似的动力学特征。
巨核细胞(Megakaryocyte,MK)除了广为人知的负责产生具有凝血、免疫等功能的血小板,也作为造血干细胞(HSC)的重要微环境,并亲自参与免疫反应,单细胞测序已经揭示了不同MK功能亚群的存在。然而巨核细胞获得不同功能的机制仍有待阐明。研究团队通过对谱系示踪系统(CD48dre; R26rox-tdTomato)区分的两种路径来源的巨核细胞进行单细胞测序,发现滋养型巨核细胞(Niche-supporting MKs)由直接分化路径(Tomato-negative)产生,免疫型巨核细胞(Immune MKs)由逐步分化路径(Tomato-positive)产生,而两种路径共同负责血小板生成型巨核细胞(Platelet-producing MKs)的产生。于此相对应,通过不同途径产生的巨核细胞在体外和体内表现出不同的功能活性。
研究团队通过在示踪小鼠体内模拟不同的生理需求,发现两种路径对巨核细胞和血小板的贡献会在不同的压力条件下做出相应的调节。在5-FU诱导的清髓压力下,造血再生需求刺激了直接分化路径来源巨核细胞的快速优先产生;而LPS诱导的炎症反应优先刺激了逐步分化路径巨核细胞的产生;失血导致的血小板消耗会同时加快两种路径来源血小板的产生。
综上,该研究开发了高效且特异性区分直接和逐步造血分化路径的命运示踪系统,首次绘制了不同造血层级每个谱系分支的周转率和分化动力学图谱,填补了造血祖细胞稳态情况下动力学研究的空白,率先将分化路径与成体巨核细胞的功能异质性联系起来。同时该研究中两种路径的血小板生成受不同生理需求所调节的结论也为探索临床多种疾病情况下血小板变化的机制提供了新思路。
中国医学科学院血液病医院-分子细胞卓越中心联合培养博士生李晶晶,中国科学院北京基因组研究所博士生刘景坤为该论文并列第一作者。分子细胞卓越中心周波研究员为该文的责任通讯作者,中国科学院北京基因组研究所王前飞研究员、李玥莹研究员,中国医学科学院血液病医院程涛教授、程辉研究员为共同通讯作者。该项工作获得了中国科技部、国家自然科学基金、上海市以及中国科学院的基金支持,分子细胞卓越中心SPF动物实验技术平台和细胞分析技术平台为本工作提供了大力支持。
文章链接:https://www.sciencedirect.com/science/article/pii/S1074761324000827
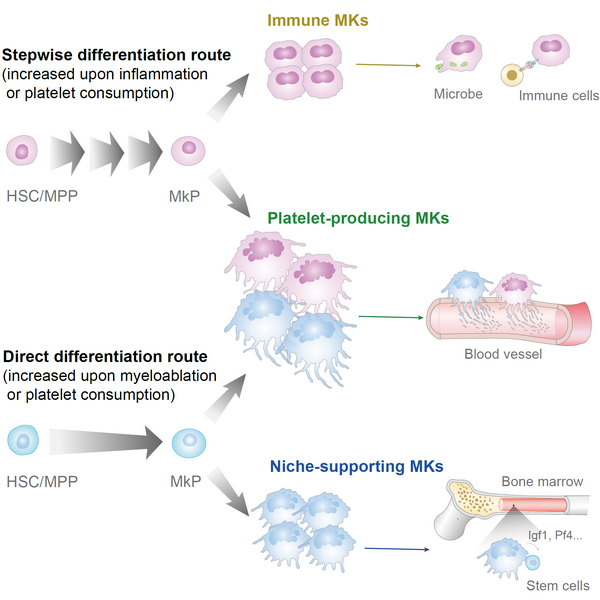
造血干细胞分化路径决定巨核细胞/血小板功能多样性示意图