4月13日,国际学术期刊Nucleic Acids Research在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周小龙研究组最新研究成果“Activity reconstitution of Kre33 and Tan1 reveals a molecular ruler mechanism in eukaryotic tRNA acetylation”。该项工作首次成功重组真核生物细胞质tRNA乙酰化修饰活力,揭示乙酰化修饰酶复合物Kre33-Tan1对底物的专一性识别机制,实现tRNA及小RNA分子上的定点高效乙酰化修饰。
在细胞内所有RNA分子中,tRNA含有最为密集且种类最为多样的转录后修饰。目前,主要发现2种RNA乙酰化修饰种类,即N4-乙酰胞苷(ac4C)及N6-乙酰腺苷(ac6A)。ac4C在三界生物以及病毒来源的多种RNA (包括tRNA、mRNA、rRNA)中均广泛存在,而ac6A只存在于古细菌来源的tRNA中。
上世纪60年代,ac4C首先在真核生物的tRNASer和tRNALeu以及细菌延伸tRNAMet (tRNAMet(e))被鉴定。在细菌tRNA中,ac4C特异性地存在于tRNAMet(e)反密码子第一位(第34位, ac4C34)。ac4C34活力重组、结构解析以及遗传学数据表明,TmcA以及TmcAL蛋白质通过两种不同的机制,分别利用乙酰辅酶A或乙酸作为乙酰供体,催化tRNAMet(e) ac4C34的生物合成。ac4C34可以阻止tRNAMet(e)的CAU反密码子与异亮氨酸AUA密码子的配对,防止AUA密码子被解码为甲硫氨酸,从而确保了细菌蛋白质合成的精确性。
就真核生物tRNA而言,ac4C专一性地存在于第12位(ac4C12)。虽然发现于上世纪60年代,直到2004年,Tan1被发现参与ac4C12形成,但Tan1没有催化活性中心,普遍认为是一个RNA结合蛋白质。2015年,真核生物tRNA ac4C12修饰酶Kre33才被鉴定。Kre33主要定位于核仁,是rRNA前体加工成熟的辅助因子。近年来,人THUMPD1 (Tan1同源蛋白质)系列点突变导致出生缺陷型神经发育异常。但长期以来,真核生物tRNA ac4C12修饰从未被成功重组,导致ac4C12生物合成的分子基础、底物识别机制、相关疾病的分子机制等完全未知,也无法基于修饰机器在特定RNA分子上实现定点乙酰化修饰。
在该项研究中,研究人员通过分析核糖体亚基前体剪接复合体中的Kre33结构,并结合AlphaFold预测的Tan1结构,合理设计表达质粒,获得高纯度的Kre33与Tan1蛋白质;通过条件优化,利用乙酰辅酶A作为乙酰化供体,实现tRNASer以及tRNALeu上的高效乙酰化修饰;系统研究了Kre33-Tan1识别tRNA底物的识别机制,提出了真核生物tRNA乙酰化修饰的“分子标尺”模型;在特定tRNA底物上实现100%乙酰化修饰效率,并实现了多种非乙酰化tRNA底物变体的高效乙酰化修饰;基于“分子标尺”模型,实现小RNA的位点特异性高效乙酰化修饰;进一步通过制备乙酰化修饰的tRNASer以及tRNALeu,揭示乙酰化修饰对于tRNA的热动力学以及氨基酰化水平没有显著影响,可能在翻译延伸的转位过程中介导了tRNA与核糖体的相互作用。
该研究首次成功重组真核生物tRNA乙酰化修饰活力并提出了乙酰化修饰酶复合物Kre33-Tan1识别底物的“分子标尺”模型,实现tRNA与小RNA分子上的定点高效乙酰化修饰。以上结果加深了对真核生物tRNA乙酰化修饰的分子机制的认识,并开发了特定RNA分子定点乙酰化修饰工具,有助于进一步研究RNA乙酰化修饰的机制与生物学功能,包括鉴定潜在的乙酰化修饰的阅读器和擦除器。
分子细胞卓越中心博士研究生马春蕊为论文第一作者,分子细胞卓越中心/国科大杭州高等研究院周小龙研究员为论文通讯作者。上海交通大学医学院许泓教授团队参与研究。感谢分子细胞卓越中心分子生物学技术平台李竑博士大力支持。该研究获科技部、国家自然科学基金委、中国科学院、上海市科委的经费资助。
文章链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkae262/7645239
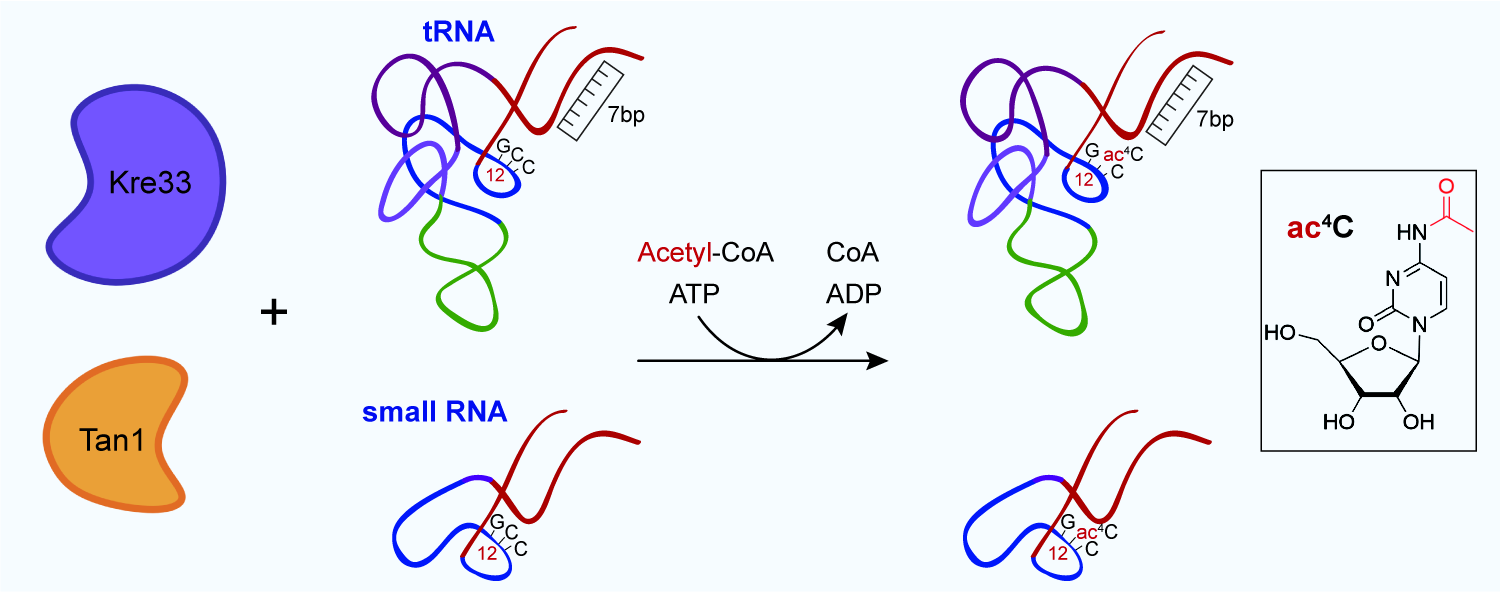
真核生物tRNA乙酰化修饰的实现与机制