4月23日,国际学术期刊Nature Biotechnology在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)陈玲玲研究组关于环形RNA的最新研究进展:“Therapeutic application of circular RNA aptamers in a mouse model of psoriasis”。该研究通过优化RNA自剪接成环的新方法,可大规模合成低免疫原性的环形RNA适配体,并实现了环形RNA适配体在PKR异常激活相关的炎性疾病小鼠模型银屑病(psoriasis)的干预治疗。
聚焦核糖核酸(RNA)前沿的基础研究拓展了人类对生命规律的认识,也催生了一系列基于RNA的生物医学技术服务人类生命健康。例如,2023年诺贝尔生理学奖颁发给信使RNA(mRNA)疫苗。环形RNA是一系列单链、共价,具有闭环结构RNA分子的统称。近十年来研究发现了环形RNA普遍表达,并具有特定的生成加工、降解代谢及功能发挥的途径与规律(详见综述Chen, Nat Rev Mol Cell Biol 2016, 2020; Liu and Chen, Cell 2022)。相较于线性RNA,环形RNA具有高稳定性、特殊折叠和低免疫原性(Zhang et al., Cell Rep 2016;Liu et al., Cell 2019;Liu et al., Mol Cell 2022),使之具备改造为新型RNA适配体、蛋白质翻译载体等潜在生物医学应用前景。利用环形RNA在疾病动物模型中实现干预治疗及在体安全性评估,对未来基于环形RNA的生物医学应用十分重要。
该研究通过优化RNA自剪接成环的新方法,实现了大规模合成低免疫原性且具有特殊双链结构环形RNA适配体(short double-stranded region-containing circular RNAs, ds-cRNAs)。利用单分子全内反射荧光显微镜(single-molecule total internal reflection fluorescence, smTIRF)在单分子水平阐明了ds-cRNA与PKR的作用机制,PKR与ds-cRNA的结合呈现为长时程、低解离的稳定结合模式,表明ds-cRNA提供了更适合PKR结合并限制其解离的空间构象。
该研究首次建立了稳定过表达环形RNA小鼠模型,能够在多种组织中普遍表达,且生长状况正常,说明了环形RNA的安全性;实现了通过靶向递送环形RNA适配体,在PKR异常激活相关的炎性疾病小鼠模型银屑病(psoriasis)的干预治疗,为环形RNA新型药物开发奠定理论基础和技术依据。
此外,陈玲玲团队在另一项研究中发现,通过AAV递送环形RNA适配体能够有效缓解阿尔兹海默症小鼠模型中神经炎症和记忆减退等症状(Feng et al., bioRxiv 2024)。
分子细胞卓越中心郭思坤博士、刘楚霄副研究员、徐奕锋博士生、王潇博士和复旦大学附属儿科医院南芳博士为该论文的共同第一作者,分子细胞卓越中心陈玲玲研究员为该论文的通讯作者。该项工作得到复旦大学生物医学研究院/复旦大学附属儿科医院杨力研究员、特拉维夫大学Dan Peer教授、分子细胞卓越中心刘珈泉研究员和北京生命科学研究所陈婷研究员的大力支持。该研究获得分子细胞卓越中心分子生物学技术平台、细胞分析技术平台及动物实验技术平台的技术支持,并获国家自然科学基金、科技部、中国科学院及上海市科委的基金支持。
文章链接:https://www.nature.com/articles/s41587-024-02204-4
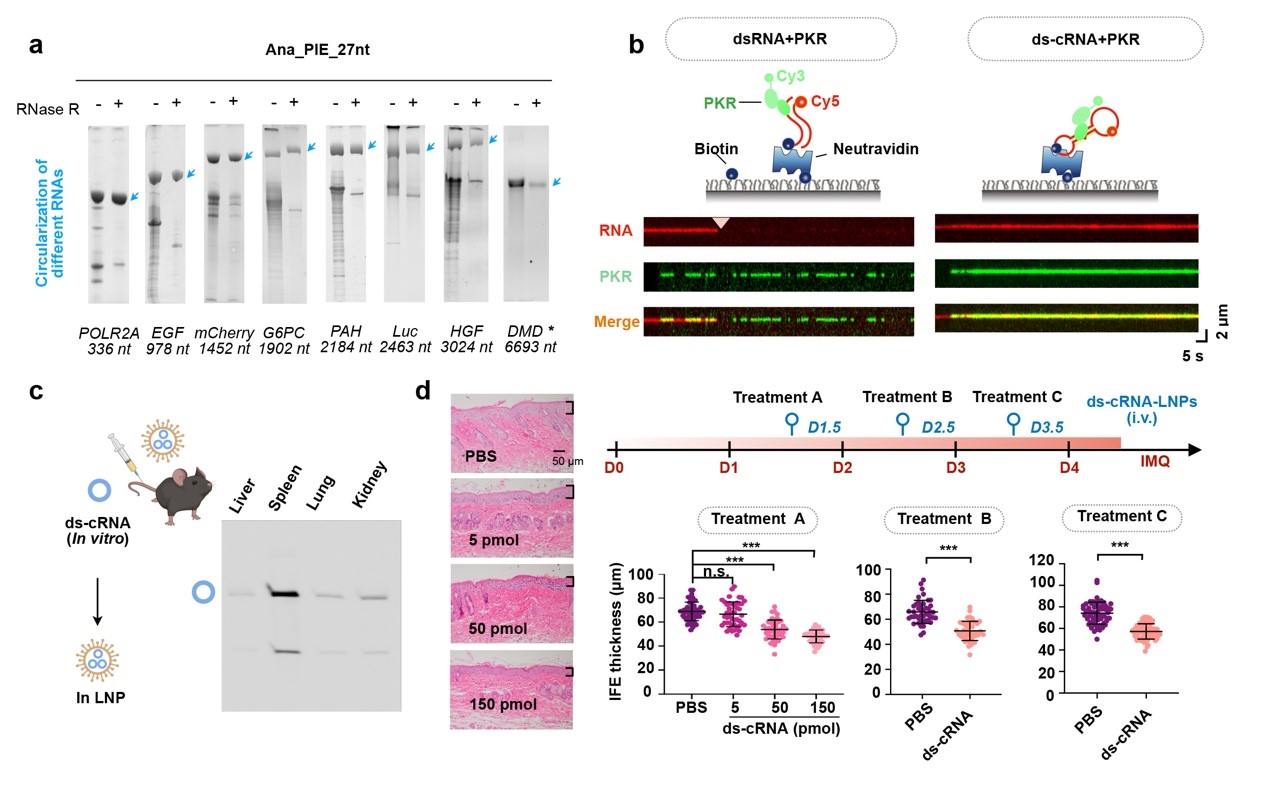
利用大规模合成低免疫原性的环形RNA适配体干预治疗银屑病小鼠模型
(a)优化体外大规模合成低免疫原性环形RNA适配体的方法,实现长度达7, 000 nt环形RNA的合成纯化。(b)利用smTIRF在单分子水平上阐明PKR-ds-cRNA动态相互作用机制。(c)LNP靶向递送环形RNA适配体至小鼠脾脏。(d)环形RNA适配体在银屑病小鼠模型中实现干预治疗。