7月4日,国际学术期刊Nature Methods在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)陈玲玲研究组关于CRISPR-dCas12a应用于DNA活细胞标记的最新研究进展:“CRISPR array-mediated imaging of non-repetitive and multiplex genomic loci in living cells”。该研究对现有的CRISPR-dCas12a系统进行了筛选优化,构建了可用于非重复序列DNA活细胞成像的CRISPRdelight系统;进一步利用CRISPRdelight系统揭示了基因位点在细胞核内的定位与其运动能力和转录活性的相关性;同时利用RNA适配体修饰的CRISPR串联序列实现了对4种卫星DNA的活细胞多色成像。
活细胞追踪DNA、RNA等核酸的空间分布和动态变化对于了解基因表达调控机制具有十分重要的意义。CRISPR-Cas系统是一种来源于细菌和古细菌体内的获得性免疫系统,由于其特异性靶向DNA/RNA的能力,已被广泛开发成多种细胞内DNA/RNA的遗传操作和检测标记的工具。陈玲玲研究组前期构建了基于CRISPR-dCas13的RNA标记系统,成功实现了对活细胞和斑马鱼胚胎内RNA的成像追踪,以及活细胞RNA多色成像(Yang et al., Mol Cell, 2019; Huang et al., Genome Bio, 2023; Yang et al., Cell Insight, 2022)。此外,经过改造的靶向DNA的CRISPR-Cas9系统可用于活细胞DNA成像标记(Chen et al., Cell, 2013; Ma et al., Nat Biotechnol, 2016)。这些CRISPR系统在标记内源核酸序列方面显示出独特的优势,然而对于非重复DNA/RNA序列的活细胞特异性成像目前仍存在着诸多限制。
CRISPR-Cas12a系统属于类型V的CRISPR-Cas家族,在靶向DNA的同时还具备将CRISPR串联序列加工成多条成熟crRNA的能力(Zetsche, B. et al., Cell, 2015)。因此,CRISPR-Cas12a系统理论上可以通过CRISPR串联序列在同一细胞内表达足够数量的crRNA,从而实现对非重复序列DNA的标记。
为了验证这一假设,研究人员选取了三种已报道的能显著提高基因编辑效率的dLbCas12a突变体,并对它们在标记微卫星DNA Sat I和Sat III方面的能力进行了比较。结果显示,hyperdLbCas12a突变体(D156R,D235R,D292R,D350R)可以实现更高的标记效率和信号质量。研究人员进一步发现hyperdLbCas12a可以加工CRISPR串联序列,并维持与直接表达成熟crRNA近似的DNA标记能力,同时筛选出了能够表达长达50次crRNA重复序列的CAG启动子,并基于此构建了用于活细胞DNA成像的CRISPRdelight系统。
研究人员针对CCAT1转录起始位点上游10kb的区域设计了48条gRNA,使用CRISPRdelight系统成功实现了CCAT1基因位点的活细胞标记。以同样的方式,CRISPRdelight系统在其他6个非重复序列基因位点均得到了有效验证,并且该系统在HCT116、U2OS以及小鼠胚胎干细胞(R1)中同样有效。CRISPRdelight系统相较于之前报道的基于CRISPR-dCas9的CARGO活细胞标记系统(Gu, B. et al.,Science, 2018),具有质粒构建成本低、周期短、可表达gRNA数量多、标记系统组成更简洁等多方面优点。
研究人员利用CRISPRdelight系统进一步分析了CCAT1在细胞核内的分布特点和运动特征。研究结果显示,位于细胞核膜处Lamin蛋白层的CCAT1位点运动能力明显弱于位于细胞核内的CCAT1位点;进一步检测CCAT1的内含子表达信号,发现Lamin蛋白层的CCAT1位点转录活性也更弱。同时,研究人员对HSPH1、HSPA1A等热休克基因进行了标记,在向细胞施加42°C或亚砷酸钠刺激后,发现定位于核斑的HSPH1基因位点会明显增多,并且位于核斑的基因位点转录活性也明显更强。这些结果表明了基因组DNA的细胞核内空间位置与其运动能力和表达活性的相关性。
最后,研究人员通过RNA结构优化,成功将BoxB、Pepper、PP7和MS2 等RNA适配子元件插入至gRNA中,利用CRISPRdelight系统和这些元件对应的融合荧光蛋白,实现了微卫星DNA Sat I、Sat II、Sat III和Sat α的活细胞四色标记。CRISPRdelight系统为研究活细胞中DNA位点的空间位置和动力学特征,提供了更简单和便利的新手段。
分子细胞卓越中心杨良中博士(已毕业)、敏逸晖硕士和刘昱昕博士为该论文的共同第一作者,陈玲玲研究员为通讯作者。该项工作得到霍华德休斯医学研究所Zhe (James) Liu教授、复旦大学生物医学研究院/复旦大学附属儿科医院杨力研究员、清华大学王海峰博士的大力支持。该研究获得分子细胞卓越中心细胞分析技术平台的技术支持,并获国家自然科学基金、科技部、中国科学院及上海市科委的基金支持。
文章链接:https://www.nature.com/articles/s41592-024-02333-3
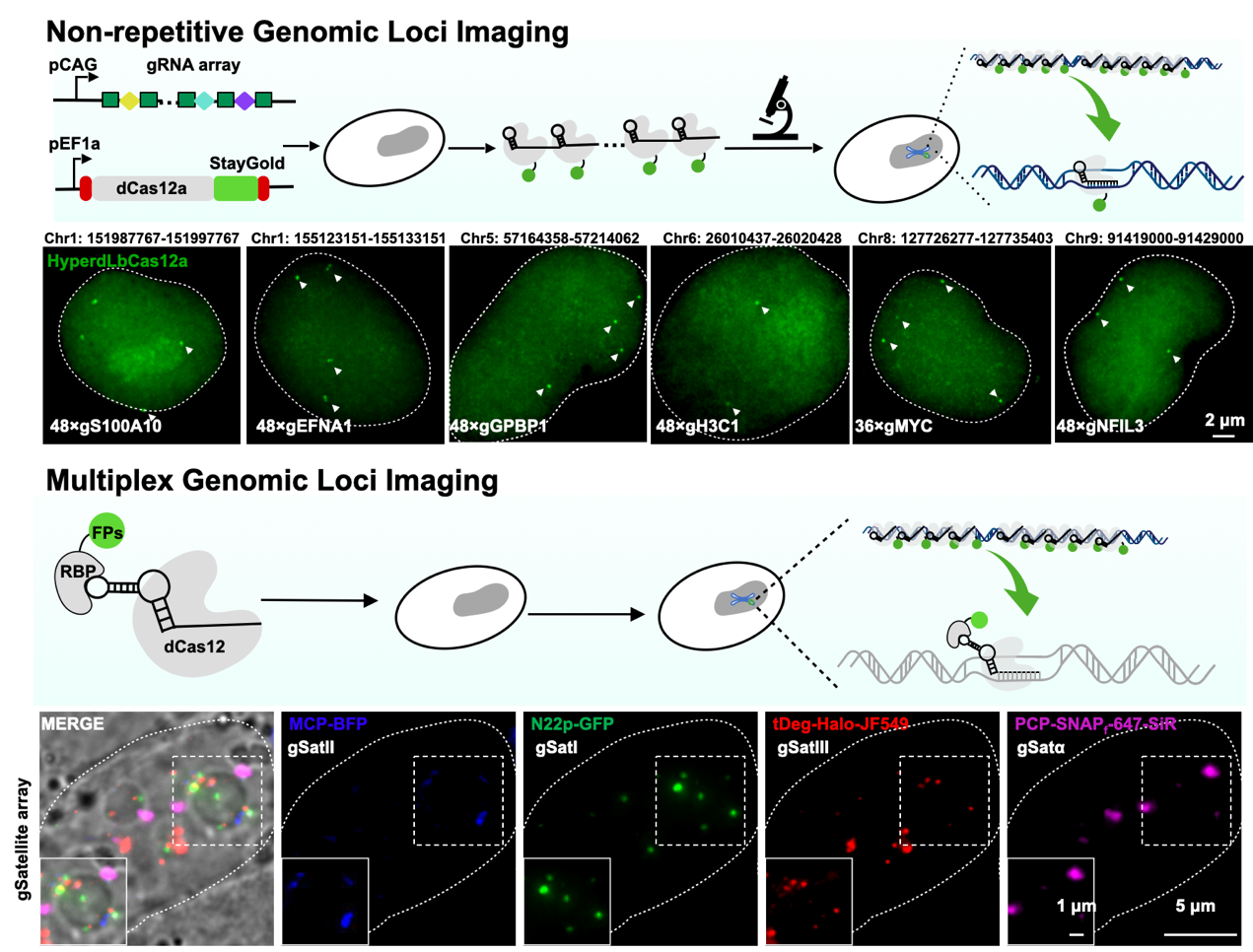
CRISPRdelight系统能够有效标记多个基因组非重复DNA位点。向gRNA中插入不同的RNA适配子后,CRISPRdelight系统能实现多个基因组位点的活细胞多色成像。