7月20日,国际学术期刊Nature Communications在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)陈剑峰研究组和同济大学生命科学与技术学院/附属养志康复医院林昶东课题组的最新合作研究成果“Ca2+ transients on the T cell surface trigger rapid integrin activation in a timescale of seconds”。该工作首次揭示了T细胞表面整合素αLβ2的在体快速活化机制,并提出了趋化因子介导整合素激活的“两阶段模型”,更新了人们对淋巴细胞定向归巢机制的认知。
淋巴细胞从血液到淋巴器官和炎症组织的归巢对免疫监视和宿主防御至关重要。这一过程涉及一个高度有序的级联粘附事件,包括选择素介导的淋巴细胞沿着高内皮小静脉(high endothelial venules, HEVs)壁的滚动粘附、整合素的激活及其介导的淋巴细胞在血管内皮表面的稳定粘附和跨血管内皮迁移。在受到淋巴细胞归巢靶点部位趋化因子的刺激下,淋巴细胞表面的整合素(如αLβ2)被激活,使得淋巴细胞从滚动粘附转变为稳定粘附,从而在特定血管靶点部位迁移渗出。传统观点认为,趋化因子与其在淋巴细胞上的GPCR受体结合诱导细胞内Rap1-RIAM信号的传递,随后促进Talin与整合素β亚基胞内结构域的结合,最终介导整合素激活,这一过程相对缓慢,通常需要几分钟时间。考虑到淋巴细胞归巢过程中在毛细血管小静脉中以30-100 μm/s的相对高速滚动,为了确保淋巴细胞归巢位点的准确性,整合素需要更快的激活机制来介导淋巴细胞滚动的快速停止。
整合素是一种金属蛋白,其功能严格依赖于生理上存在于血清中游离的毫摩尔水平的Ca2+和Mg2+。陈剑峰团队的前期研究表明,Ca2+通过与整合素β亚基I结构域中ADMIDAS金属离子结合位点,使整合素保持低活性状态,并且去除细胞外Ca2+可诱导整合素在数秒内快速激活。尽管该现象已经在体外实验中被发现了二十多年,但一直没有证据表明这种机制可以在体内发挥作用,因为血液中Ca2+浓度相对稳定。近年来的研究发现,趋化因子(如CCL25)与其对应受体(如CCR9)结合时,可以通过SOCE(store-operated calcium entry)和CRAC(calcium-release activated calcium)方式诱导Ca2+快速内流。因此,该研究提出了趋化因子通过触发细胞钙内流引起细胞表面微环境Ca2+快速下降,从而引起整合素快速活化的假设。
在这项研究中,研究人员首先在体外分别搭建了实时监测T细胞近膜端外侧Ca2+浓度([Ca2+]ex)的CEPIAexternal(calcium-measuring organelle-entrapped protein indicator)系统,以及通过检测整合素αLβ2两个亚基之间的距离反应整合素激活的FRET(fluorescence resonance energy transfer)系统。随后,研究人员构建了在T细胞中同时表达这两套系统的小鼠模型(R26-LSL-CEPIAexternal;Itgal-LSL-Clover;Itgb2-LSL-mRuby2;CD4-Cre mice)。通过分离的T细胞进行体外实验以及活体成像实验,研究人员发现趋化因子CCL25诱导的Ca2+内流导致T细胞表面的[Ca2+]ex在6秒内从生理浓度1.2 mM迅速下降到0.3 mM,这是诱导整合素αLβ2激活的临界Ca2+阈值,并在28秒内进一步下降到最低水平0.09 mM,αLβ2的亚基I结构域的金属离子结合位点与Ca2+的解离介导αLβ2第一阶段的“快速激活”,T细胞实现由滚动粘附向稳定粘附的迅速转化。随后,在数分钟内,通过经典的由内向外信号通路介导αLβ2第二阶段的“慢速激活”,进一步促进了T细胞稳定粘附和跨血管内皮迁移。Talin敲低显著抑制了αLβ2的“慢速激活”,但不影响[Ca2+]ex下降触发的“快速激活”。在咪喹莫特诱导的小鼠银屑病模型中,通过小分子抑制剂SKF96365阻断T细胞Ca2+内流可显著抑制T细胞在炎症血管内皮部位由滚动粘附向稳定粘附的转变及其向炎症皮肤部位的归巢,从而减轻小鼠皮肤炎症。
该研究结果首次揭示了T细胞整合素αLβ2的在体快速活化机制,直接证明了趋化因子通过诱导T细胞表面Ca2+瞬时降低来实现整合素在数秒内被快速激活;并提出了趋化因子介导整合素激活的“两阶段模型”。该研究成果填补了领域内趋化因子初始刺激和传统认为的整合素相对缓慢的由内向外激活之间的空白,更新了人们对淋巴细胞定向归巢机制的认知。这种机制使淋巴细胞在血管内皮表面滚动时对遇到的趋化因子等刺激迅速作出反应,停止快速滚动并最终实现向炎症感染部位的精准定位。阻断免疫细胞的Ca2+内流可能是在涉及异常免疫细胞运输的病理过程中调节免疫细胞归巢的新策略。
分子细胞卓越中心李悦博士、王诗慧博士后、张有华博士和同济大学生命科学与技术学院/附属养志康复医院林昶东研究员为该文共同第一作者,陈剑峰研究员和林昶东研究员为该文共同通讯作者。该研究得到分子细胞卓越中心葛高翔研究员和曾艺研究员的指导和帮助。该研究获得国家自然科学基金委、科技部、中国博士后科学基金、博士后创新人才支持计划、上海市科委和中央高校基本科研业务费专项资金和干细胞与转化IV类高峰学科等项目的基金支持,并获得分子细胞卓越中心细胞分析技术平台和动物实验技术平台的大力支持。
文章链接:https://www.nature.com/articles/s41467-024-50464-0
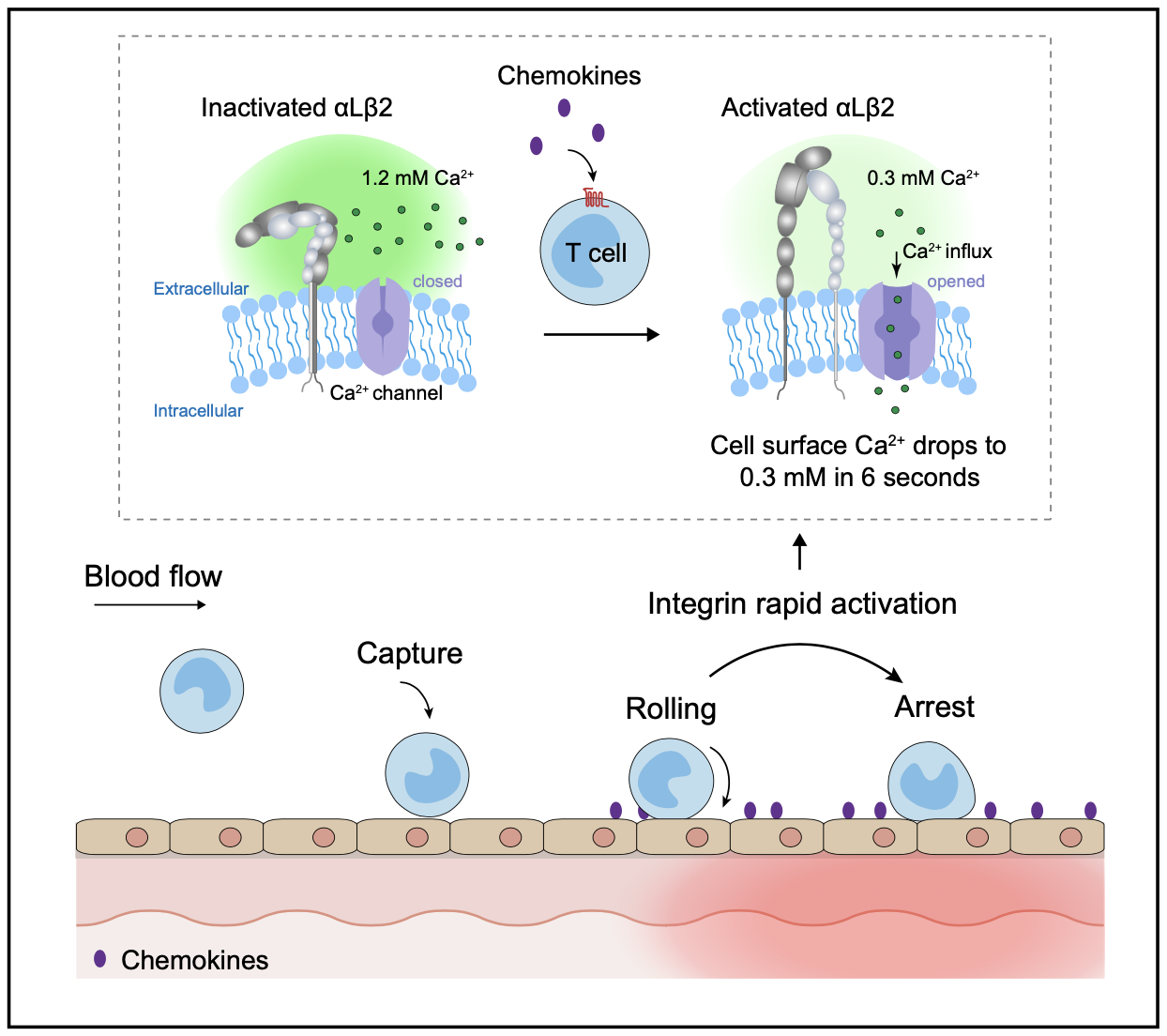
趋化因子通过触发T细胞Ca2+内流快速激活整合素保证T细胞定向归巢