8月1日,国际学术期刊Neuron在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)汪胜研究组和中国科学院上海药物研究所徐华强团队合作研究成果:“Structural basis of psychedelic LSD recognition at dopamine D1 receptor”。该研究通过解析致幻剂LSD在其靶点多巴胺D1受体(DRD1)的结构,结合系统性的药理学研究,阐明了LSD在不同靶点中的动力学特征及其对信号转导产生的影响。此外,该研究还以DRD1为模型证明了G蛋白对受体的稳定作用不仅作用于胞内侧高度动态的TM6和TM5还作用于胞外侧高度动态的ECL2区域,这些稳定作用进一步影响LSD结合受体的动力学特征。
LSD,又名D-麦角酸二乙酰胺,是一种众所周知的半人工合成致幻剂,对感知、情绪和认知具有重大影响。尽管LSD等致幻剂被普遍认为仅具有致幻作用,并伴随一定的不良反应,但后续的临床研究却表明,这些药物在治疗难治性抑郁症和酒精成瘾等精神障碍方面展现出巨大的治疗潜力。通常情况下,药物在体内的药效持续时间,除了与其对靶点的高亲和力相关外,还与其在靶点的停留时间密切相关。LSD等经典致幻剂都具有复杂的药理学特征,靶向众多的G蛋白偶联受体(GPCR)。研究组的前期研究工作表明,LSD在5-HT2AR受体(其精神活性的主要靶点)和血清素2B受体(5-HT2BR)中表现出缓慢的解离速度(Cell, 2017; Science, 2022),这可能是其发挥长效幻觉体验的基础,但对于LSD其他靶点的动力学信息仍然匮乏,其是否具有快速解离特征,以及此快速解离特征是否介导了及时药效尚不明确。
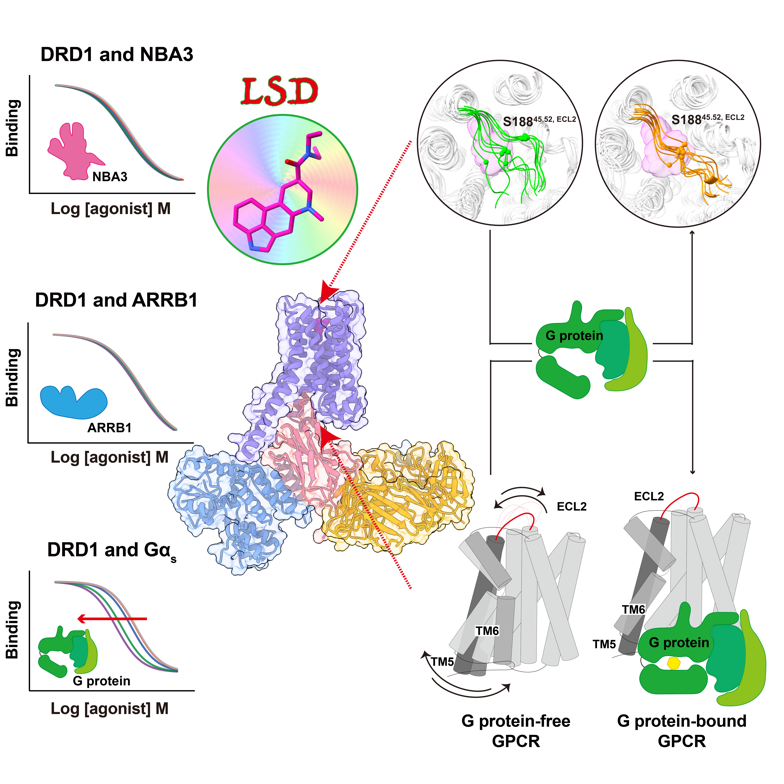
此外,GPCR具有高度动态性,受体中配体所表现出的动力学特征在一定程度上与受体本身的动力学特征密切相关。GPCR下游的两条重要信号通路分别对应不同的效应蛋白:G蛋白和β-arrestin,它们在下游信号传导过程中发挥着不同的功能,前者通过结合激活状态的GPCR并稳定该状态,而后者的具体作用方式未知。从已解析的结构中分析,G蛋白通过介导受体跨膜螺旋5(TM5)和跨膜螺旋6(TM6)的胞内段向外摆动来稳定活性构象,这是GPCR活化的显著特征之一。然而,其对受体细胞外结构域即配体结合口袋处的动力学影响仍不明确,特别是对具有高度动态性的第二个胞外环(ECL2)的影响,以及这些影响对于药物结合解离动力学的贡献。这也就意味着,受体动力学特征与配体动力学的关系仍不清楚。近年来,GPCR结构生物学研究如火如荼,结构信息加速了新药的研发,现阶段主要致力于发现选择性的化合物或者是具有信号偏向性的化合物,以避免副作用的产生,从而达到更好的疗效。鉴于化合物在受体中的动力学特征与其药效息息相关,药物研发的下一个热点将聚焦于具有特定动力学特征的化合物开发。
在该研究中,研究人员筛选并改造得到了与活化状态DRD1相互作用的纳米抗体NBA3,药理学研究表明NBA3是一个在DRD1中模拟β-arrestin信号特征的纳米抗体。在NBA3的辅助下,研究人员利用冷冻电镜技术解析了LSD结合的DRD1的结构,明确了LSD的结合特征。与前期研究组解析的血清素2A/2B受体不同,LSD在DRD1中具有独特结合模式,具体表现为其麦角碱骨架朝向受体跨膜螺旋4(TM4)。此外,结构信息还揭示了G蛋白偶联受体与β-arrestin偶联受体的关键决定因素分别为二者间具有电荷互斥作用力与电荷互吸作用力。
动力学研究结果表明,与LSD在血清素2A/2B受体上的缓慢解离速度(半数解离时间长达数小时)不同,LSD在DRD1中的解离速度异常快(半数解离时间仅仅几十秒),这归因于受体ECL2的高度动态性。此外,研究人员以DRD1为模型,通过同位素竞争结合实验以及分子动力学模拟实验发现,只有G蛋白,而不是β-arrestin,才能稳定受体高度动态的ECL2区域,从而显著减慢LSD的解离速度。这一观察结果与既定概念相一致,即GPCR的激活始于G蛋白稳定受体,促进下游信号传导,随后β-arrestin被募集以使受体脱敏,信号终止。G蛋白和β-arrestin对受体动力学的这种差异调节反过来作用于配体动力学本身,导致LSD诱发的幻觉体验变化。总结而言,研究人员证实区别于β-arrestin,G蛋白通过稳定受体胞内侧TM6和TM5以及胞外侧ECL2共同使得受体维持在其稳定状态,进而对配体动力学产生一定的调控,具体表现为配体在受体中的停留时间延长,配体与受体之间的亲和力增强,这在很大程度上贡献了配体的高效能药效。
综上所述,这项研究解析了LSD与其靶点DRD1的结构,丰富了LSD在不同靶点中的动力学特征,揭示了GPCR受体动力学与配体动力学的调控机制,为进一步研究GPCR的动力学、信号传导和药理学的功能意义奠定了基础,加速了具有特定动力学特征化合物的研发。
国科大杭高院生命学院樊鲁玉博士后,上海药物所庄友文博士(现任上海交通大学研究员),分子细胞卓越中心吴鸿宇博士研究生以及上海科技大学黎慧琼博士研究生为该论文共同第一作者。分子细胞卓越中心-国科大杭高院汪胜研究员、上海药物所徐华强研究员以及国科大杭高院樊鲁玉博士后为该论文的共同通讯作者。该研究得到了国家自然科学基金、科技部重点研发项目、中国科学院战略先导研究项目和上海市科技重大专项等项目的支持。该研究获得分子细胞卓越中心细胞分析技术平台、分子生物学技术平台和化学生物学技术平台给予的支持。
文章链接:https://doi.org/10.1016/j.neuron.2024.07.003
GPCR受体动力学与配体动力学调控关系