10月9日,国际学术期刊Nucleic Acids Research在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周小龙研究组与南京医科大学沈彬团队、山东大学齐鲁医院焉传祝团队的最新合作研究成果“Taurine hypomodification underlies mitochondrial tRNATrp-related genetic diseases”。该研究揭示了牛磺酸修饰缺陷是线粒体tRNATrp相关遗传疾病的潜在致病因素。
tRNA是mRNA翻译机器的核心成员。约80%的RNA修饰发生在tRNA上,其中tRNA反密码环是修饰最为集中的区域。反密码环上的修饰确保了密码子与反密码子的精确配对,调控翻译效率和保真性。
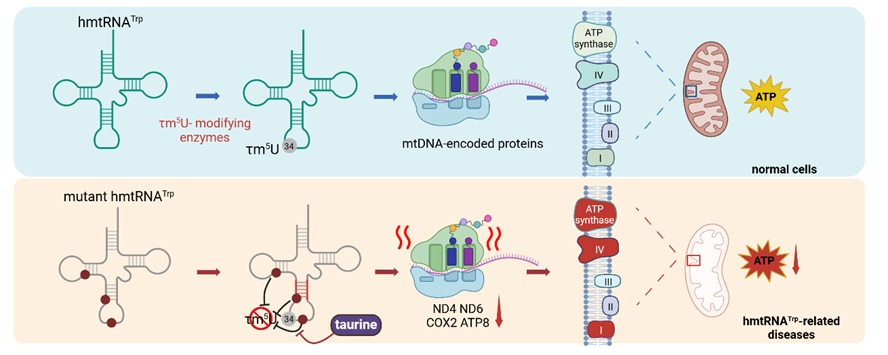
线粒体是细胞的能量工厂,拥有一套独立的蛋白质合成系统。人线粒体基因组编码22种线粒体tRNA (mtRNA), 负责合成13种线粒体基因组编码的蛋白质,对于线粒体氧化磷酸化复合物的合成、组装和功能发挥具有重要作用。mtRNA修饰谱包含18种转录后修饰,其中5种mtRNA的第34位尿嘧啶上含有5-牛磺酸甲基尿嘧啶(τm5U)或其衍生修饰5-牛磺酸甲基-2-硫尿嘧啶(τm5s2U),由GTPBP3及MTO1复合物介导。τm5U只发生在高等真核线粒体tRNA上,细菌tRNA或低等真核生物(例如酵母)线粒体tRNA对应位置含有结构类似的5-羧甲基氨基甲基(cmnm5U)修饰,由MnmE及MnmG复合物(MnmEG)介导。
早期研究发现,位于mtRNALeu(UUR)上的m.3243A>G和mtRNALys上的m.8344A>G突变导致τm5U缺陷,无法有效解码同源密码子,最终分别引发线粒体脑肌病伴乳酸中毒及中风样发作综合征(MELAS)和肌阵挛性癫痫伴随红纤维病(MERRF)。除这两种tRNA外,临床报道其余三种携带τm5U或τm5s2U的tRNA (mtRNAGln、mtRNAGlu、mtRNATrp)上,也存在若干突变导致线粒体疾病。然而,这些遗传变异是否也引起τm5U修饰缺陷一直未被知晓。另一方面,长期以来,由于无法获得具有高效催化活力的τm5U修饰酶GTPBP3与MTO1复合物,mtRNA突变导致τm5U修饰缺陷的机制也尚不清楚。
在该研究中,研究人员尝试利用大肠杆菌MnmEG复合物(EcMnmEG)对mtRNA进行交叉识别。通过在原核表达系统中共纯化得到一个自然组装的EcMnmEG复合物,其对大肠杆菌tRNA具有较高的cmnm5U修饰活力;发现EcMnmEG具有氨基酸和tRNA底物的可塑性,能够在mtRNATrp上引入cmnm5U和τm5U修饰;利用这样一套独特的修饰系统,体外生化实验发现mtRNATrp反密码茎环和D茎上的致病变异会破坏U34修饰;进一步地,通过线粒体转化得到MELAS患者来源的杂交细胞系(m.5541C>T细胞系),并通过线粒体基因编辑系统获得两种mtRNATrp突变细胞系(m.5532G>A和m.5545C>T细胞系),证实了mtRNATrp反密码茎环和D茎上的选择性突变在细胞内引起τm5U缺陷,并导致线粒体基因组编码的蛋白质含量降低以及氧化磷酸化复合物的组装缺陷,最终导致线粒体代谢功能障碍。最后,研究人员发现,在m.5541C>T细胞培养中补充底物牛磺酸能够有效提升τm5U修饰水平和tRNA稳态水平,显著改善突变对于线粒体功能的损伤。
该研究利用EcMnmEG的底物可塑性特征,基于患者来源细胞或基因编辑细胞系,揭示若干mtRNATrp致病突变通过降低τm5U修饰进而影响线粒体翻译、复合物组装与线粒体功能;发现补充牛磺酸可以显著改善患者来源细胞的线粒体功能损伤。该研究为深入理解mtRNATrp相关遗传疾病的致病机制与开发潜在干预策略提供了新的基础。
分子细胞卓越中心博士研究生鲁嘉莉、南京医科大学博士研究生戴奕晨和山东大学齐鲁医院副研究员纪坤乾为该文共同第一作者,分子细胞卓越中心/国科大杭州高等研究院周小龙研究员、南京医科大学沈彬研究员和山东大学齐鲁医院焉传祝教授为论文共同通讯作者。该研究获得了科技部、基金委、中国科学院和上海市科委的经费资助。分子细胞卓越中心分子生物学技术平台李竑博士参与了该研究。感谢法国斯特拉斯堡大学Gilbert Eriani教授对本研究提出的建议。
文章链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkae854/781598
牛磺酸修饰缺陷是线粒体tRNATrp相关遗传疾病的潜在致病因素