11月11日,国际学术期刊Nature Reviews Immunology在线发表了中国科学院分子细胞科学卓越创新中心许琛琦研究组联合中国科学院深圳先进技术研究院合成生物学研究所施小山研究团队的展望文章:“Charge-based immunoreceptor signalling in health and disease”。该文章深入探讨了一类普遍存在的信号基序 — 碱性残基富集序列(basic-residue-rich sequence, BRS),明确其基本定义,总结了其近膜信号转导机制,阐述了免疫受体BRS突变与人类疾病的相关性,并探讨了BRS在创新免疫疗法中的应用潜力。
免疫受体信号转导的机制研究与临床应用一直是生物医药的前沿热点,既是免疫学最基本的科学问题,同时也是开发创新免疫疗法的关键。现阶段,免疫疗法基本都是基于免疫受体的信号调控策略所开发,例如免疫检查点阻断疗法、CAR-T和TCR-T细胞疗法等。免疫受体均为跨膜蛋白质,而跨膜蛋白质中存在近膜正电残基是经典生化教科书中的已知结论。但是这些序列的信号机制、生理病理功能和应用前景却没有系统性研究。
该文首先对人类单跨膜蛋白的序列特点展开了系统性分析,发现70%的人类单跨膜蛋白的胞内近膜区均富含碱性残基,遂将这类序列定义为碱性残基富集序列(BRS)。BRS通常为10个氨基酸长度,携带两个或更多的净正电荷,常位于胞内的近膜区,也可以分布于远膜的位置。至今,抗原受体(T细胞受体、B细胞受体)、共刺激受体、共抑制受体、NK细胞受体、Fc受体、细胞因子受体等多种免疫受体的BRS已有实验报道。
基于现有研究报道,该文对BRS介导的近膜静电调控网络理论进行了总结。BRS可以与细胞膜和近膜区携带负电荷或电子的脂质和蛋白质分子发生静电相互作用,而环境因子可以进一步调控这些相互作用,形成时空动态的近膜静电网络。目前已报道的静电调控网络成员包括:BRS、酸性磷脂(如PS、PI(4,5)P2)、甾醇分子(如胆固醇、羟化胆固醇)、正电金属离子(如钙离子)、富含负电荷或Π电子的膜蛋白或近膜蛋白(如LCK、p85、LAG3、PLCγ1)等。通过近膜静电网络,BRS能够调节免疫受体的磷酸化、泛素化、液液相分离、机械信号转导等过程,覆盖了免疫受体的静息、触发、信号放大、信号衰减和降解等生命周期。
该文同时对BRS突变与疾病相关性以及BRS的转化应用前景进行了系统性梳理。通过对UniProt数据库的系统分析发现,已经有超过100个疾病相关的BRS突变被记录,然而大部分的具体致病机制仍然有待研究。BRS的转化应用前景包括天然存在的免疫受体中BRS的信号调控以及利用BRS设计合成免疫受体。甾醇代谢物7α-羟基胆固醇可以削弱细胞膜脂质分子的排列致密性,帮助TCR信号亚基CD3ε的BRS更好地与膜结合,从而在TCR-T细胞的制备中,抑制TCR的基底磷酸化信号,提升记忆细胞的比例,提高免疫治疗的长效性。另一方面,在二代CAR分子中加入CD3ε信号区后形成的E-CAR分子具有更好的信号转导能力,其中BRS可以通过cation-Π键的方式介导液液相分离的产生,帮助细胞形成更成熟高效的免疫突触,从而提升E-CAR-T细胞的抗原敏感性和长效性。除了CAR,BRS对于另一种合成受体SNIPR的高效信号转导同样至关重要。
最后,文章指出膜蛋白组中拥有种类丰富的BRS库,具有广阔的应用前景。然而,现阶段对BRS信号转导机制的理解以及应用仍然十分有限,未来还有一系列重要的问题亟需解决。例如,BRS是否可以分成多个亚类?不同的亚类是否有具有不同的信号调节模式?各类BRS突变如何导致人类疾病?如何理性操控BRS信号或者理性设计含有BRS的合成受体?这些问题的解答将极大地提升我们对免疫系统的认识并帮助免疫疗法的开发。
分子细胞卓越中心许琛琦研究员和中国科学院深圳先进技术研究院合成生物学研究所施小山研究员为该论文的共同通讯作者。该项工作获得国家科技部、上海市科学技术委员会及中国科学院的项目支持。
文章链接:https://www.nature.com/articles/s41577-024-01105-6
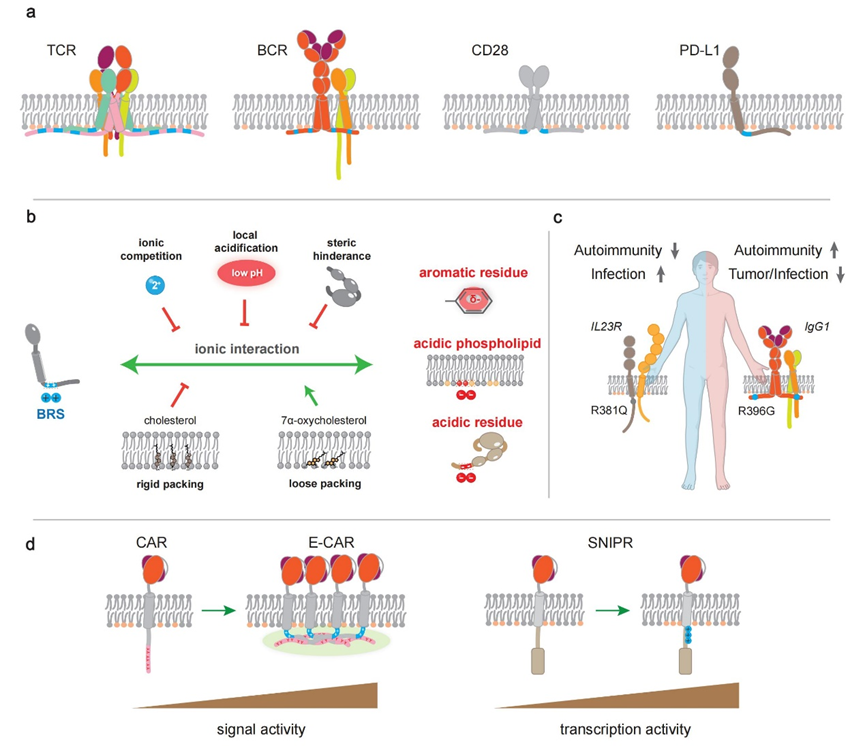
碱性残基富集序列(BRS)介导的免疫受体信号转导机制与转化应用。a,BRS(蓝色)广泛存在于各类免疫受体的胞内近膜区;b,BRS通过时空动态的近膜静电网络调控免疫受体的信号与功能;c,BRS突变与人类疾病紧密相关;d,利用BRS设计合成受体极具转化应用前景。