11月25日,国际学术期刊Cell Discovery在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)丛尧研究组联合上海交通大学附属瑞金医院蒙国宇研究组的最新合作研究成果:“Cryo-EM structure of PML RBCC dimer reveals CC-mediated octopus-like nuclear body assembly mechanism”。该研究首次解析了PML46-256二聚体的冷冻电镜结构,揭示了PML-RBCC结构域的排布方式和PML蛋白的二聚模式,及独特的“章鱼状”PML核体组装机制。该研究为以PML核体为中心的AML以及其他PML相关实体瘤的靶向治疗和预后提供了理论基础。
急性髓系白血病(AML)是最常见的血液恶性肿瘤,占所有急性白血病的70%,死亡率高且治疗手段有限,复发率约为30%。早幼粒细胞白血病蛋白(PML),又称TRIM19。PML基因与RARα基因融合,生成PML/RARα融合癌蛋白,是急性早幼粒细胞白血病(APL)的致病因素。PML蛋白在细胞核内形成高度有序的PML核体(nuclear bodies,NBs),作为超分子复合体和无膜亚细胞器,广泛参与DNA损伤反应、细胞凋亡和细胞衰老等信号通路的调控。PML/RARα融合癌蛋白可以破坏PML核体,从而加速APL的发病进程;PML蛋白异常还与某些实体瘤的发生和治疗密切相关。然而,由于全长PML蛋白难于纯化及其在生理条件下高度聚集,PML的完整结构及PML核体的组装机制亟待阐明。
研究团队克服了PML蛋白极易聚集、分子量小、冷冻样品分布的取向倾向性等困难,首次解析了PML46-256二聚体(分子量小于50kDa)的冷冻电镜结构。结合交联质谱和生化分析,在分子水平上阐明了其RING、B1、B2和coiled-coil(CC)结构域的折叠和分布,以及PML蛋白的二聚模式。
在此基础上,研究团队进一步综合应用交联质谱分析、AlphaFold 2预测、核体形成实验及哺乳动物双杂交实验等手段,进一步完善了PML的结构功能信息与PML核体的生物发生机制:在PML单体中,RING、B1和B2结构域围绕α3螺旋排列,并位于PML分子的外表面。随后,通过以α6螺旋为中心的疏水相互作用界面形成PML二聚体。在PML二聚体的背景下,CC螺旋像两条长尾一样从其两侧向外延伸,并远离α6-α6二聚界面。由α6螺旋介导的PML二聚体可能在coiled-coil结构域的招募下像章鱼触须一样把周围的PML分子拉近,并且RING和B1结构域之间的结合界面可以促进PML从寡聚化向更高阶组装的转变,进一步完成了PML蛋白的组装和堆叠。同时,伴侣蛋白通过伴侣SIM和PML-SUMO相互作用的招募,加上LLPS的影响,最终形成了直径为0.1至2μm的PML核体。
综上所述,该研究首次解析了PML-RBCC二聚体的冷冻电镜结构,揭示了PML蛋白的二聚模式,及其独特的coiled-coil结构域介导的“章鱼状”的PML核体招募与组装机制,即PML二聚体(Dimer A)的每个CC螺旋能够与相邻的PML二聚体(Dimer B)以反平行的方式相互作用,迅速招募临近的PML分子,最终形成直径约为2μm的无膜亚细胞器。该研究使得PML核体组装的机制得到完善,为以PML核体为中心的AML以及其他PML相关实体瘤的靶向治疗和预后提供了理论基础。
上海交通大学附属瑞金医院博士研究生谭阳霞、分子细胞卓越中心博士研究生李佳蔚、上海交通大学生命科学技术学院/瑞金医院博士研究生张士彦和张永磊为该论文共同第一作者。上海交通大学附属瑞金医院蒙国宇教授和分子细胞卓越中心丛尧研究员为该论文的共同通讯作者。该研究得到了上海市科委基础重点项目、国家自然科学基金、中国科学院战略性先导科技专项、“上海市教委高峰临床医学资助项目”、“上海高等学校特聘教授(东方学者)项目”等基金的支持。并得到国家蛋白质科学研究(上海)设施的冷冻电镜系统、质谱系统、数据库与计算分析系统和蛋白质表达纯化系统的大力支持。
文章链接:https://www.nature.com/articles/s41421-024-00735-3
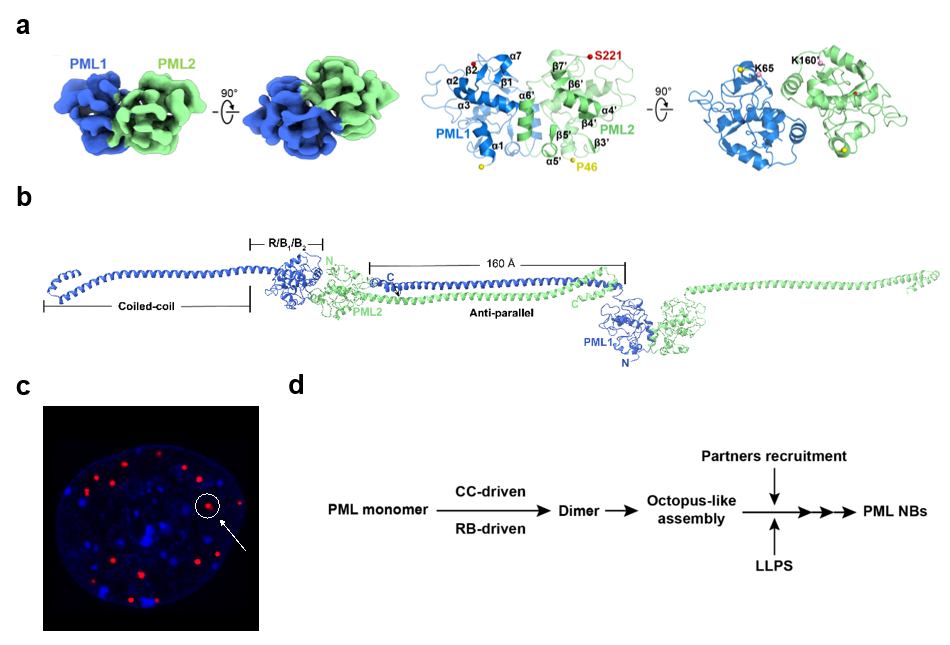
PML46-256二聚体结构及PML核体组装机制。(a)PML46-256二聚体的冷冻电镜结构。(b)PML核体通过独特的“章鱼状”机制进行组装。(c)PML核体。(d)PML NB的生物发生机制假说。