嵌合性抗原受体(Chimeric antigen receptor, CAR)是一种人工合成的免疫受体,整合了抗体的抗原识别区、T细胞抗原受体(T cell receptor, TCR)的信号区以及共刺激分子的信号区。利用基因工程方法在T细胞中外源表达CAR后,产生的CAR T细胞可以针对特定抗原产生免疫应答反应。CAR T细胞治疗已获批应用于肿瘤治疗领域,并且在自身免疫病中也展示了很好的应用前景,未来还可以应用于感染、器官纤维化、衰老等多种场景。与天然的受体TCR相比,CAR的抗原敏感性差,并且与其它信号分子的协同性差。这些劣势是因为CAR无法像TCR一样形成成熟的免疫突触来整合各条信号通路。这些信号的劣势会导致CAR T细胞无法清除抗原表达量低的靶细胞,并且容易发生功能耗竭,无法长期工作。优化CAR的信号转导功能是突破当前CAR T细胞治疗临床瓶颈的关键所在。
11月27日,国际学术期刊Immunity在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)许琛琦研究组联合上海科技大学王皞鹏研究组的最新合作成果:“Phase separation of chimeric antigen receptor promotes immunological synapse maturation and persistent cytotoxicity”。该研究在传统二代CAR分子胞内段引入TCR中的CD3ε元件(E-CAR),并且对CD3ε进行了序列优化,提高E-CAR在细胞膜上的稳定性。E-CAR分子可以通过cation-pi相互作用产生液液相分离,帮助免疫突触的形成与成熟;这不仅增强了E-CAR分子本身的信号功能,也能招募CD2等共刺激分子,更好地利用内源共刺激信号。E-CAR T细胞比普通的CAR T细胞具有更高的抗原敏感性,以及更好的持续杀伤能力,在初发肿瘤和复发肿瘤的动物模型中,展示了更好的抗肿瘤功能。当前,E-CAR已进入临床试验阶段,展示了很好的应用前景。
CD3ε信号转导机制
大多数T细胞的TCR主要由抗原识别亚基TCRαβ和信号传递亚基CD3εδ,CD3εγ,CD3ζζ组成。CD3分子富含多处功能序列,可以结合不同信号分子,发挥各种调控功能。其中,CD3ε分子的N端是一段碱性氨基酸富集区(Basic amino acid-rich sequence,BRS),紧接着是一段脯氨酸富集区(Proline-rich sequence,PRS),C端则由一段包含RK序列的免疫受体酪氨酸激活基序(Immunoreceptor activation tyrosine-based motif,ITAM)组成。许琛琦团队及其合作者在前期研究中发现,当T细胞处于静息状态时,BRS与细胞质膜的酸性磷脂发生静电相互作用,将CD3ε的胞内区屏蔽在膜内,防止T细胞产生过强的基底信号(Xu et al., Cell 2008);抗原刺激TCR后,钙离子大量内流,中和酸性磷脂的负电荷,从而打破BRS和酸性磷脂的静电相互作用,释放CD3ε胞内区(Shi et al., Nature 2013);CD3ε BRS随后和酪氨酸激酶LCK发生静电相互作用,促进TCR-LCK的液液相分离,增强TCR的磷酸化,并进一步促进LCK的活化(Chen et al., PNAS 2023)。磷酸化的CD3ε ITAM可以招募抑制性激酶CSK,抑制LCK活性,并打破TCR-LCK相分离,使得TCR信号回归基线,防止细胞过度活化(Wu et al., Cell 2020)。基于这些研究成果,许琛琦团队于2024年荣获国家自然科学二等奖。
许琛琦团队进而将CD3ε引入二代CAR分子,设计出了在功能上更加模拟TCR的第一代E-CAR。在本研究中,团队发现E-CAR 1.0的胞内信号区自身就能够形成液液相分离,而传统二代CAR分子的相分离现象较弱。这种相分离主要由CD3ε的碱性氨基酸和其它信号区上的酪氨酸所带的pi电子形成的cation-pi相互作用所介导。在细胞水平,E-CAR 1.0更易于在细胞表面聚集,然而E-CAR在膜上的表达水平比传统CAR低。因此,研究团队通过蛋白序列优化,构建了一种E-CAR 2.0版本(B6I),在保留其相分离所需碱性氨基酸的基础上,有效地提高了膜表达水平。
免疫突触
T细胞与靶细胞接触时形成高度有序的超分子激活簇(Supramolecular activation cluster,SMAC),成熟的TCR免疫突触通常是具有“牛眼“样结构,由TCR形成的central SMAC(cSMAC),由黏附分子LFA-1形成的peripheral SMAC(pSMAC)和富含磷酸酶CD45的distal SMAC(dSMAC)组成。pSMAC和dSMAC之间还有共刺激受体CD2形成的花冠结构,富含CD28,ICOS等多种共刺激分子和PD-1等共抑制受体,共同调控T细胞信号。多层有序的免疫突触结构确保了信号的有效传递。很多研究表明CAR分子不能形成经典的免疫突触结构,CAR分子形成的通常是不规则的微簇结构,这导致其对抗原信号传递低效和对共刺激信号利用不足(Gudipati et al., Nat Immunol 2020;Burton et al., PNAS 2023;Dong et al., EMBO J 2020)。与TCR相比,传统CAR分子只利用了CD3ζ链作为其主要信号传递亚基。其余CD3链的缺失可能导致CAR无法形成成熟的免疫突触。
由于抗原受体聚集是免疫突触形成的基础,E-CAR相分离促进了免疫突触成熟,不仅提升了E-CAR在cSMAC中的信号转导功能,还在外周形成更好的CD2花冠结构,招募PI3K这些信号分子来介导共刺激信号。团队还注意到,E-CAR免疫突触呈现出信号先放大后减弱的动态性,与TCR形成的免疫突触非常相似。
E-CAR功能优势
团队随后对E-CAR T细胞的功能展开了研究,发现其对弱抗原肿瘤细胞的结合与杀伤都更强。通过建立肿瘤细胞反复刺激模型,团队发现E-CAR T细胞的长效杀伤效果更好,在清除肿瘤细胞的同时还可维持自我增殖。RNA测序结果显示E-CAR T细胞可以利用CD2信号来缓解功能耗竭,这与其能诱导形成CD2花冠结构这一现象吻合。在血液瘤和实体瘤的初发肿瘤动物模型以及血液瘤复发的动物模型中,E-CAR T细胞都比传统的细胞表现出了更好的抗肿瘤效果。
综上所述,这一研究通过蛋白设计,构建了可相分离的新型E-CAR分子,提高了免疫突触质量,从而提高了抗原敏感性和细胞持续性,在动物模型中取得了良好的疾病治疗效果。
分子细胞卓越中心许琛琦研究员和上海科技大学生命科学与技术学院王皞鹏研究员为该论文的共同通讯作者。分子细胞卓越中心博士研究生徐心怡,上海科技大学与分子细胞卓越中心联合培养硕士研究生陈昊天,分子细胞卓越中心博士研究生任正旭,国科大杭州高等研究院硕士研究生徐晓敏为该论文共同第一作者。该研究获国家自然科学基金委、科技部重点研发计划、中国科学院青年团队、上海市科委等项目资助。该研究得到分子细胞卓越中心动物实验技术平台、细胞分析技术平台和分子生物学技术平台的大力支持。
文章链接:https://www.cell.com/immunity/fulltext/S1074-7613(24)00520-X?
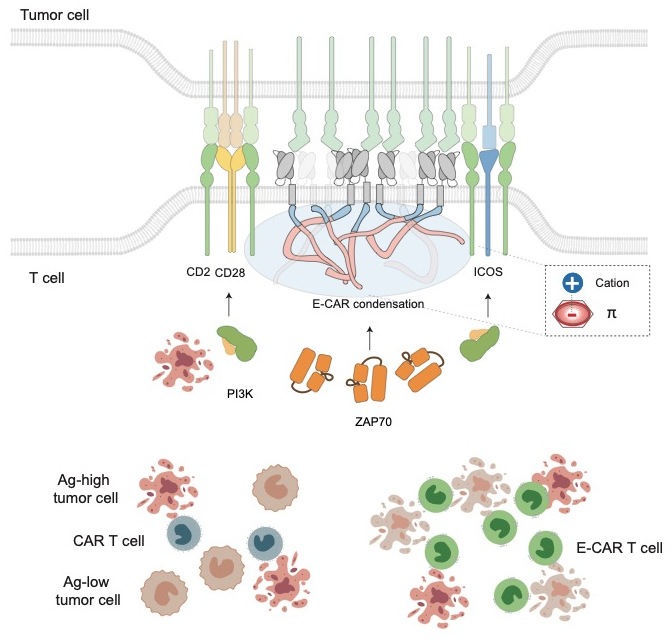
相分离E-CAR促进T细胞免疫突触成熟,从而提高抗原敏感性和细胞长效性