2月17日,国际学术期刊Molecular Cell在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)陈玲玲研究组与复旦大学生物医学研究院杨力研究组关于内源环形RNA降解的最新研究进展: “Degradation of circular RNA by the ribonuclease DIS3”。该研究解析了生理条件下环形RNA被核酸内切酶DIS3监控降解的新机制,实现了对环形RNA“生老病死”过程中特异调控及分子特征等基础研究的闭环。
环形RNA主要由mRNA前体外显子反向剪接而成,具有区别于线性RNA的生成加工、转运代谢及功能发挥途径与调控规律(见综述Annu Rev Cell Dev Biol 2022; Cell 2022)。已知在应激条件下,双链RNA病毒激活核酸酶RNase L可以导致环形RNA 大规模降解(Cell 2019)。然而正常条件下,仅有个别含m6A修饰或具特殊结构的环形RNA可以被降解(见综述Nat Rev Mol Cell Biol 2020)。因此,正常条件下环形RNA代谢稳态维持的分子机制尚不清楚。
由于环形RNA的闭环结构,一般认为其对核酸外切酶不敏感,而是依赖于核酸内切酶。基于该推测,研究人员首先通过对不同核酸内切酶(包括ANG, DIS3, ERN1, G3BP1, RNASE4, RNAESH2A和SMG6)以及辅因子(UPF1和UPF2)敲降筛选,发现敲降核酸内切酶DIS3引起细胞内大部分(> 65%)环形RNA的表达上调。研究人员通过使用核酸内切酶失活的DIS3突变体(D146N)进行回补实验和RNA Immunoprecipitation (RIP)实验,验证了这些环形RNA的表达上调依赖DIS3的核酸内切酶活性,且DIS3能够直接结合由DIS3敲降引起的表达上调的环形RNA。更进一步的研究表明,DIS3介导的环形RNA降解途径在人和小鼠中高度保守。
已知,DIS3具有核酸内切酶活性和3'-5'端的核酸外切酶活性,在从细菌到人等大多数生物中广泛存在。之前研究认为DIS3是核酸外切酶复合体(exosome complex)的重要组分,在细胞核内发挥调控RNA加工、成熟及质量监控的作用(见综述Nat Rev Mol Cell Biol 2016) 。然而深入研究发现,DIS3具有不依赖于核酸外切酶复合体,在细胞浆内降解环形RNA的全新途径和机制。研究人员首先通过蔗糖密度梯度离心实验发现DIS3介导的环形RNA降解途径发生在细胞浆中;免疫荧光共定位发现,仅有10%的DIS3与核酸外切酶复合体组分(如EXOSC8和EXOSC9)共定位,提示DIS3具有不依赖于核酸外切酶复合体的功能。其次,通过结合蔗糖密度梯度离心实验、DIS3敲降实验和高通量测序,对筛选出DIS3偏好降解的环形RNA与非DIS3偏好降解的环形RNA进行深入的序列比较分析,鉴定到具有U-rich motif的环形RNA易被DIS3识别和降解。更重要的是,通过建立环形RNA的切割实验,证明了体外合成的环形RNA在体外和细胞内均有可控的稳定性,即含有U-rich 基序数目不同,可改变环形RNA的稳定性,且该过程依赖DIS3的活性。
综上,该工作不仅揭示了正常细胞状态下DIS3介导的全转录组水平环形RNA降解的新途径,发现了DIS3不依赖于核酸外切酶复合体的全新功能,也为体外合成稳定性可控的环形RNA奠定重要理论基础,有利于拓展其生物医学应用。该工作揭示的生理条件下环形RNA被监控降解的全新机制也是该研究团队历时十余年系统完成的对环形RNA从生成加工、功能发挥、转运出核、合成应用、到代谢降解等过程研究中的重要一环。
分子细胞卓越中心陶笑博士,中国科学院上海营养与健康研究所博士研究生翟思楠,分子细胞卓越中心刘楚霄副研究员为该论文的共同第一作者,分子细胞卓越中心陈玲玲研究员为该论文的主要通讯作者,复旦大学生物医学研究院杨力研究员为该论文的共同通讯作者。该项工作获得国家自然科学基金、科技部、中国科学院、上海市科委以及新基石科学基金会的支持,获分子细胞卓越中心分子生物学技术平台和化学生物学技术平台的帮助与支持。
文章链接:https://www.cell.com/molecular-cell/abstract/S1097-2765(25)00046-2
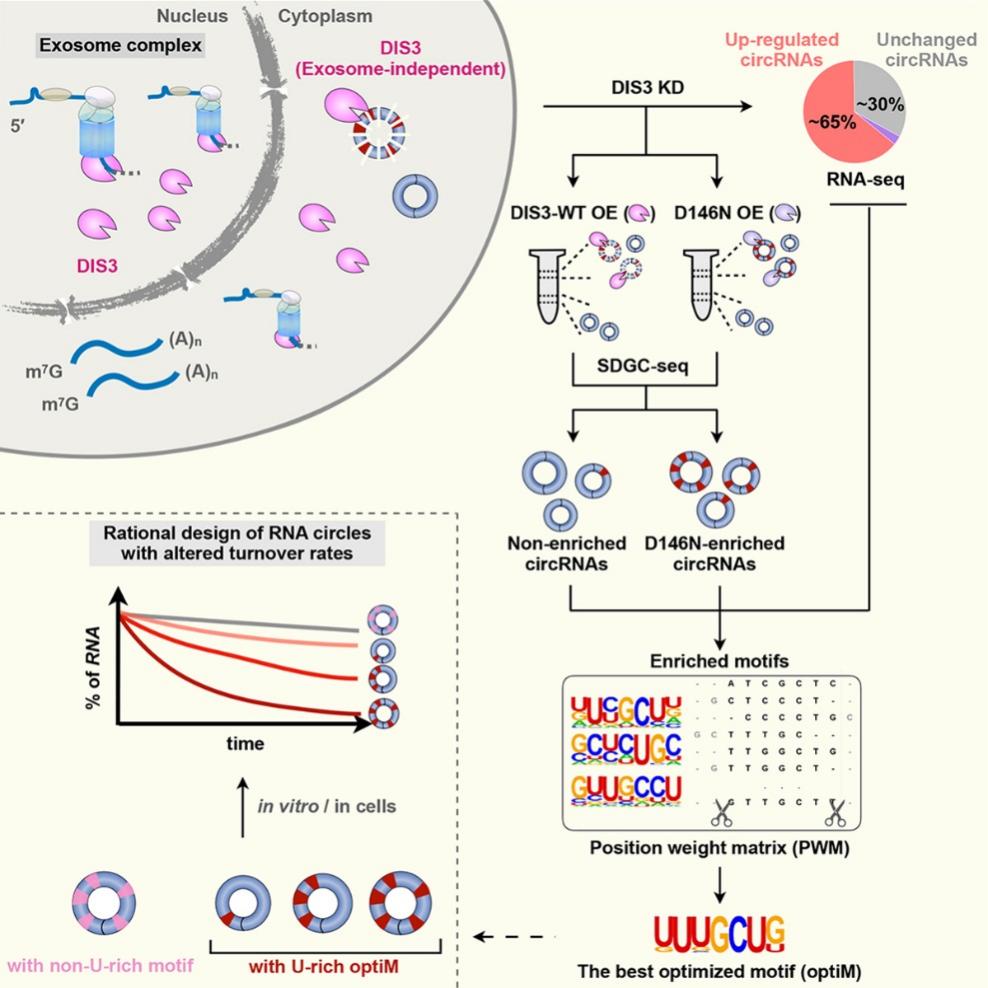
核酸内切酶DIS3降解环形RNA及其机制