3月4日,国际学术期刊Cell Research在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)童明汉研究组、复旦大学蓝斐团队和北京大学汤富酬团队的最新研究成果:“SETD1B-Mediated Broad H3K4me3 Controls Proper Temporal Patterns of Gene Expression Critical for Spermatid Development”。该研究通过绘制小鼠精子发生全过程的高分辨率表观遗传图谱,系统阐述了表观遗传修饰在精子发生过程中的动态变化规律,揭示了不同发育阶段基因沉默机制的多样性,阐明了SETD1B介导的broad H3K4me3在精子细胞发育中的关键作用。
精子发生是雄性生殖细胞发育的核心过程,依赖于基因表达的精确调控。然而,由于睾丸组织的复杂性,此前对精子发生过程中基因表达调控的细节尚不清晰。童明汉团队曾通过荧光标记小鼠和精子发生同步化技术,建立了分离高纯度、任意发育阶段生精细胞的策略,并与蓝斐团队、汤富酬团队、李劲松团队合作,先后绘制了精子发生过程的单细胞转录组图谱和减数分裂中DSB命运决定的表观遗传图谱。这些工作为深入研究精子发生调控机制提供了重要的基础。
表观遗传修饰通过动态调控基因的激活与抑制,被认为在精子发生过程中发挥重要调控作用。然而,该过程中表观遗传修饰谱的动态变化及其功能机制尚未被系统地研究过。在最新研究中,团队构建了首个覆盖小鼠精子发生全过程的高分辨率表观遗传图谱,涵盖7种组蛋白修饰(H3K27ac、H3K4me1、H3K4me3、H3K27me3、H3K9me2、H3K9me3、H3K36me3)、DNA甲基化和染色质可及性;全面而系统地展示了精子发生过程中转录组变化和染色质重塑的表观遗传学基础。研究发现,在抑制型组蛋白修饰中,H3K27me3和H3K9me2在有丝分裂向减数分裂转换及减数分裂重组完成过程中发生了两次重排。第一次重排始于B型精原细胞,表现为H3K9me2显著增加和H3K27me3全局丢失,而H3K9me3保持稳定。这种变化可能与减数分裂基因的沉默有关,尤其在不活跃基因上更为显著。第二次重排发生在中偶线期粗线期精母细胞(mP),此时H3K9me2全局性丢失,而H3K27me3迅速重新建立,标记那些在mP阶段前由H3K4me3覆盖、但在mP阶段后需要沉默的基因。这表明不同发育阶段的基因沉默由不同的表观遗传机制介导。
在活跃型组蛋白修饰中,H3K4me3和H3K27ac的变化显著高于其他修饰,尤其是在圆形精子阶段。研究发现,圆形精子阶段的H3K4me3升高主要以“broad H3K4me3”形式存在,宽度通常大于5 kb,远超常规H3K4me3修饰(约1-2 kb)。Broad H3K4me3主要修饰精子形成关键基因的启动子/增强子区域,与基因的高表达密切相关,并在人类精子细胞中高度保守。进一步研究利用条件性基因敲除小鼠模型证实,SETD1B是特异性介导broad H3K4me3的修饰酶,其敲除导致雄性不育。机制研究表明,broad H3K4me3修饰能够招募更多的RNA聚合酶II(Pol II)和转录前起始复合物(PIC)成分,促进基因的高效表达。SETD1B缺失时,broad H3K4me3修饰消失,导致Pol II和PIC组分重新分布到常规的typical H3K4me3修饰区域,使得原本应在特定阶段高效表达的基因无法正常表达,而不表达的基因却错误地高表达,影响了基因表达的时序性。
综上所述,本研究构建了首个覆盖小鼠精子发生全过程的高分辨率表观遗传图谱,全面而系统地揭示了精子发生过程中转录组变化和染色质重塑的表观遗传学基础,为精子生物学研究领域提供了全面完整的表观遗传学基础数据,为生殖生物学和表观遗传学的研究提供了新的研究方向和思路。而SETD1B介导的broad H3K4me3修饰的发现及其功能阐述,为表观遗传修饰如何协调发育过程中基因转录时序性提供了重要见解。
分子细胞卓越中心林震博士,复旦大学荣博文博士、吕瑞途博士为文章的共同第一作者;童明汉研究员、蓝斐教授、汤富酬教授、吕瑞途博士为共同通讯作者。该研究得到了科技部国家重点研发计划、国家自然科学基金、上海市科委等的支持;分子细胞卓越中心动物实验技术平台为本工作提供了支持。
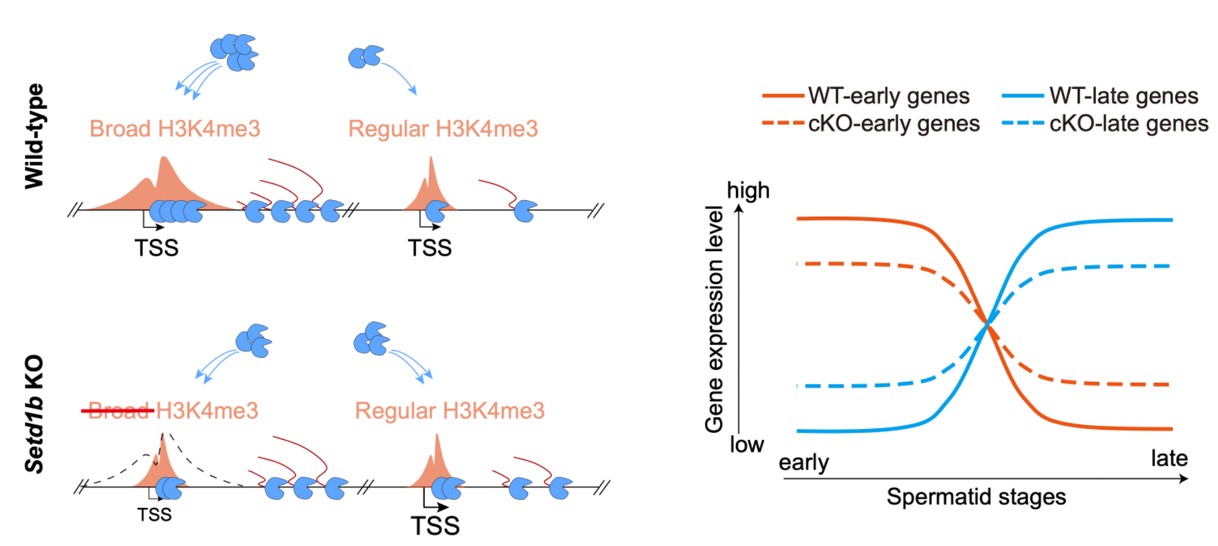
图:SETD1B介导的Broad H3K4me3调控精子形成中的转录时序性