3 月21日,国际学术期刊iScience在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)胡红雨研究组的研究论文:“Designer polyQ fusion proteins sequester USP7/HDM2 for modulating P53 functionality”。该研究基于多聚谷氨酰胺(Polyglutamine, PolyQ)融合蛋白技术,提出了一种全新的调制细胞功能的策略方案。通过人工设计的PolyQ融合蛋白特异性地募集USP7或HDM2到包涵体中,降低靶蛋白USP7或HDM2的可利用率,从而调控细胞中P53蛋白的稳定性和下游基因的表达。这一策略不仅为靶向P53信号通路提供了新的思路,同时也为肿瘤治疗开辟了一种可能的干预途径。
蛋白质积聚(Aggregation)是细胞内广泛存在的生物学过程。然而,近年来的研究发现,蛋白质积聚也可能对细胞的信号通路起着一定的调控作用。USP7和HDM2是P53信号通路的核心调控因子,它们分别通过去泛素化或泛素化过程调节P53蛋白的稳定性。USP7的去泛素化活性可延长HDM2的半衰期,增强其对P53蛋白的泛素化作用,降低P53的蛋白质水平;而HDM2作为E3泛素连接酶直接介导P53蛋白的降解。因此,PolyQ融合蛋白靶向抑制USP7或HDM2可能成为增强P53功能,抑制肿瘤进展的有效策略。
在本研究中,研究人员设计并构建了一系列PolyQ融合蛋白,其中PolyQ-IRF(IRF序列:SPGEGPSGTG)融合蛋白能够有效募集USP7,并降低其在细胞中的可溶性和可利用率,从而影响USP7对P53蛋白的调控作用。并且,该融合蛋白还能够通过影响USP7对HDM2的去泛素化作用,促进HDM2的降解,间接增强P53的稳定性。PolyQ-PMI(PMI序列:TSFAEYWNLLSP)可直接募集HDM2,减少其可溶性和可利用率,从而影响其对P53的泛素化能力,增强P53蛋白的稳定性。这些PolyQ融合蛋白通过稳定P53蛋白增强其转录活性,进而促进P53下游基因P21和PUMA的表达。。该研究不仅验证了PolyQ融合蛋白在调制P53信号通路中的功效,同时也为基于PolyQ融合蛋白技术的肿瘤靶向治疗提供了新的潜能。
本成果为研究蛋白质积聚与细胞信号通路的关系提供了新的视角,同时也为开发肿瘤治疗策略提供了新的研究思路,展现出潜在的应用价值。同时,PolyQ融合蛋白技术可能具有更广泛的应用潜力,未来可进一步探索该技术在其它信号通路中的应用,为人类疾病的靶向治疗提供更多的可能性。
分子细胞卓越中心博士研究生张祥乐为该论文的第一作者,胡红雨研究员为通讯作者。该研究得到了国家自然科学基金委和中国科学院相关项目的资助,并得到了分子细胞卓越中心分子技术平台和细胞技术平台的大力支持。
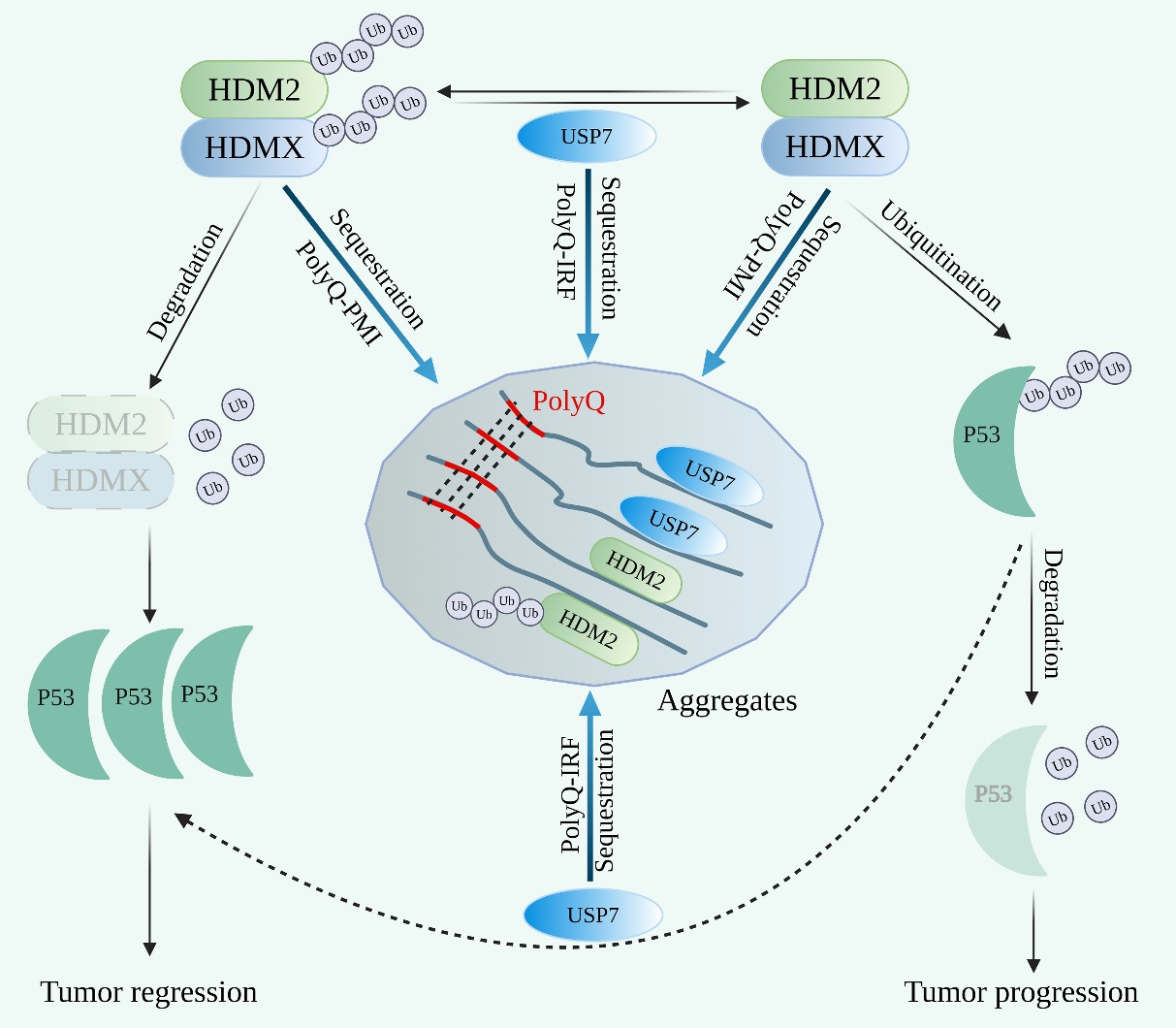
PolyQ融合蛋白对USP7和HDM2的募集作用及对P53稳定性的影响。PolyQ-IRF融合蛋白可以通过其融合的IRF序列将USP7募集到积聚物中,该过程降低细胞中USP7的溶解性和可利用率,影响了其对HDM2的去泛素化过程,从而增强了P53的稳定性。PolyQ-IRF融合蛋白还可以通过HDM2与USP7的相互作用将HDM2募集到积聚物中,减少HDM2的可用率,进一步增加P53的稳定性。另一方面,由于USP7可能直接使P53蛋白去泛素化,过度募集USP7可能会干扰P53的去泛素化途径,导致P53的稳定性降低。PolyQ-PMI融合蛋白可以通过其融合的PMI序列直接将HDM2募集到积聚物中,减少细胞中HDM2的溶解性和可利用率,导致P53泛素化的减少和稳定性的增强。[引自Zhang et al, iScience (2025), doi:org/10.1016/j.isci.2025.112025]。
文章链接:https://www.cell.com/iscience/fulltext/S2589-0042(25)00285-8