5月27日,国际学术期刊 Cell在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)陈玲玲研究组的最新研究成果:“De novo assembly of nuclear stress bodies rearranges and enhances NFIL3 to restrain acute inflammatory responses”。该研究解析了热休克等刺激条件下诱导产生的无膜亚结构—核应激小体(nuclear stress bodies,nSBs)的精细层级结构和动态组装过程,并揭示其通过拉近与基因的三维距离,促进NFIL3等基因转录。NFIL3上调会抑制炎症因子的表达,从而参与调控急性炎症反应,该过程与脓毒血症患者生存率呈正相关。该成果揭示了细胞核应激小体具有重要的基因表达调控功能,并为脓毒血症的精准诊疗提供了新思路。
真核生物细胞核是细胞遗传与代谢的控制中心,内部高度组织化,形成了诸多无膜区室,称为细胞核亚结构。这些由DNA、RNA和蛋白质组成的细胞核亚结构组成和形态各异,参与基因表达调控并具有重要的生理意义。核应激小体是灵长类动物细胞在应对诸如亚砷酸钠(SA)、热休克(HS)等不同理化刺激时形成的一种特有的细胞核亚结构,由微卫星重复序列Satellite III (SatIII) DNA,SatIII RNA和多种蛋白质组成。多年来围绕核应激小体的研究主要揭示其能够通过滞留相关剪接因子参与调控RNA的选择性剪接。然而,重复性SatIII RNA序列的转录程度、核应激小体的精细结构和组装机理、以及其是否具有生理病理学功能仍不清楚。
在本研究中,研究组对亚砷酸钠或热休克刺激后的HeLa细胞进行了三代全长转录组测序(Long-read RNA-seq),发现组成型沉默的SatIII DNA在全基因组15个染色体上广泛转录表达,其中以9号染色体q12区域(9q12)表达丰度最高。随后,研究组利用实验室前期开发的活细胞DNA和RNA成像工具(Mol Cell, 2019;Cell Insight, 2022; Nat Methods, 2024)实现了对于活细胞中SatIII DNA和SatIII RNA的实时标记。研究发现,在两种刺激条件下,9号染色体SatIII异染色质区域体积显著扩张到刺激前的2倍左右,异染色质状态逐渐开放。同时,热休克转录因子HSF1迅速结合该区域并转录出SatIII非编码RNA,在100分钟后形成初始核应激小体。同时SatIII RNA招募更多的HSF1、转录调控因子BRD4以及RNA转运/剪接因子等30余个蛋白质,组装成高度有序,具有层级结构的核应激小体。
采用酪胺信号放大测序技术(TSA-Seq)标记核应激小体邻近的基因组区域,并检测刺激后细胞的基因表达变化,研究组发现亚砷酸钠处理后有46个基因的表达可能受到核应激小体形成的影响(热休克处理后有30个基因),称为SEED-UP基因。qPCR检测确认刺激后这些基因在HeLa细胞和巨噬细胞系THP-1细胞中表达上调;而SatIII RNA 敲降后,核应激小体结构崩解,基因的上调趋势也明显减弱。这些结果提示这部分基因的表达增强很有可能受核应激小体的形成调控。利用双色标记DNA荧光原位杂交(DNA FISH)以及基因位点的活细胞标记发现,一些关键基因如NFIL3在核应激小体形成后,在空间上与其靠近。同时NFIL3和GPBP1等SEED-UP基因位点处染色质可及性增强,启动子区域更易与招募至核应激小体处的转录因子HSF1和BRD4结合,共同促进这些SEED-UP基因的高效转录。
值得一提的是,NFIL3是转录因子,抑制关键炎症因子如肿瘤坏死因子α(TNF-α)、白细胞介素8(IL-8)和白细胞介素1β(IL-1β)的表达。研究组在热休克和病原体相关分子模式(PAMPs)刺激的人外周血单核细胞(PBMCs)来源的巨噬细胞中观察到核应激小体的形成,同时NFIL3的表达显著增强,使炎症因子可控表达。如果干扰核应激小体的产生,NFIL3转录减少,下游炎症因子水平显著升高,证实了细胞核应激小体在调节炎症反应中的关键作用。
脓毒血症是由感染引发的全身性炎症反应综合症,病死率高。研究组在收集的临床样本中发现,脓毒血症患者体内有不同程度的SatIII RNA表达和细胞核应激小体产生,且NFIL3与SatIII RNA表达量和核应激小体活跃度呈正相关。此外,SatIII RNA表达高的患者生存率更高,提示细胞核应激小体形成过程可能参与抑制脓毒血症患者中炎症反应的过度增强;同时也提示SatIII RNA可以作为脓毒血症精准治疗分型标志物,也为此类炎症疾病治疗带来潜在靶点。
此项研究工作利用超高分辨率生物成像、活细胞成像、多种生化与分子生物学方法、以及临床样本等多种研究手段,发现细胞核内组装的核应激小体能够调控急性炎症反应,揭示了灵长类生命体利用产生核应激小体来应对危机的精妙策略,也为脓毒血症诊疗提供了全新视角。
分子细胞卓越中心博士生刘肖奇,分子细胞卓越中心博士后及海军军医大学第一附属医院(上海长海医院)李攀副教授,中国科学院上海营养与健康研究所/复旦大学生物医学研究院博士生高宝青为该论文的共同第一作者,陈玲玲研究员为通讯作者。该项工作得到复旦大学生物医学研究院/复旦大学附属儿科医院杨力研究员和西湖大学于洪涛教授等的大力支持。该项工作获得科技部、中国科学院、上海尚思自然科学研究院以及新基石科学基金会的经费支持,并得到分子细胞卓越中心细胞分析技术平台,分子生物学技术平台和细胞库/干细胞技术平台的帮助和支持。
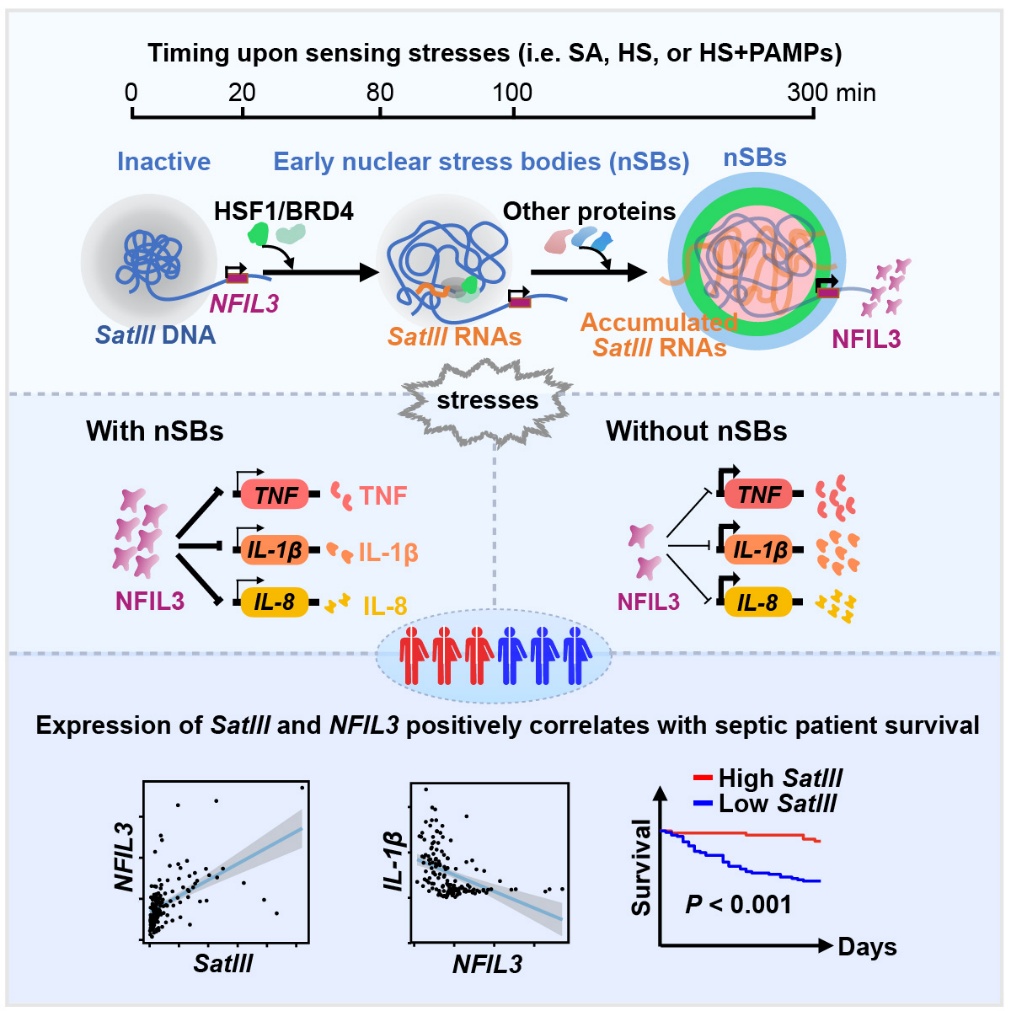
细胞核应激小体 (nSBs) 的从头组装参与调控急性炎症反应
文章链接:https://www.cell.com/cell/abstract/S0092-8674(25)00514-8