5月28日,国际学术期刊Structure在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)丁建平研究组的研究成果:“The MIT domain of STAMBP autoinhibits its deubiquitination activity”。该研究首次发现去泛素化酶STAMBP的MIT结构域对该酶的去泛素化酶活性具有自抑制功能,通过解析STAMBP 的MIT-CD复合物的晶体结构,结合体外功能分析,阐明了STAMBP全长蛋白活性调控的分子机制,为理解STAMBP在膜受体转运过程中的功能提供了分子基础。
去泛素化酶STAMBP是一种JAMM家族锌离子依赖型异肽酶,能特异性催化K63连接型泛素链的断裂,在ESCRT介导的细胞表面受体运输中发挥关键功能。STAMBP由多个结构域构成,其N端的MIT结构域可以与ESCRT-III复合体组分CHMP蛋白结合,其C端的MPN结构域(CD)发挥催化功能,而中间的连接区包含一个结合ESCRT-0组分STAM蛋白的SBM基序。先前的研究基于对截短体蛋白的结构与生化分析,揭示了STAMBP通过SBM基序与STAM相互作用,从而增强CD去泛素化酶活性的分子机制,但对全长蛋白活性的调控机制尚不清楚。
本研究首次系统性地分析了全长STAMBP去泛素化活性的调控机制。研究人员发现,与单独的催化结构域相比,全长蛋白的去泛素化活性显著降低。通过定性和定量酶活分析,研究人员证实了这种活性差异源于其N端MIT结构域对全长蛋白的自抑制作用。进一步的相互作用分析结果显示,MIT可以直接结合CD,二者的亲和力达到0.5微摩的水平。通过解析MIT-CD复合物的晶体结构,研究人员观察到,MIT占据了CD上负责结合底物中远端泛素的位点,从而阻碍了底物的结合、发挥自抑制的功能。随后,研究人员从MIT与CD的相互作用以及全长蛋白活性两个角度,对MIT-CD相互作用界面的关键氨基酸进行了定点突变分析,验证了晶体结构中观测到的相互作用对全长蛋白自抑制的贡献。此外,研究人员还分别分析了STAM1和CHMP3的结合对STAMBP全长蛋白活性的影响,发现CHMP3的结合不影响全长蛋白的活性,而STAM1的结合则根据泛素链长度的不同,可以不同程度的增强全长蛋白的活性。总之,这项研究工作从分子水平上阐明了全长STAMBP蛋白的活性调控机制,为深入理解ESCRT介导的受体回收过程中诸多调控蛋白之间的协作关系提供了全新的视角。
分子细胞卓越中心丁建平研究组博士研究生陈子岳为本文第一作者,丁建平研究员为通讯作者。在此,特别感谢上海同步辐射光源晶体学线站BL02U1、BL18U1和BL19U1、分子细胞卓越中心分子生物学技术平台对本研究给予的大力支持。该研究获得科技部重点研发计划项目和中国科学院战略性先导科技专项的经费支持。
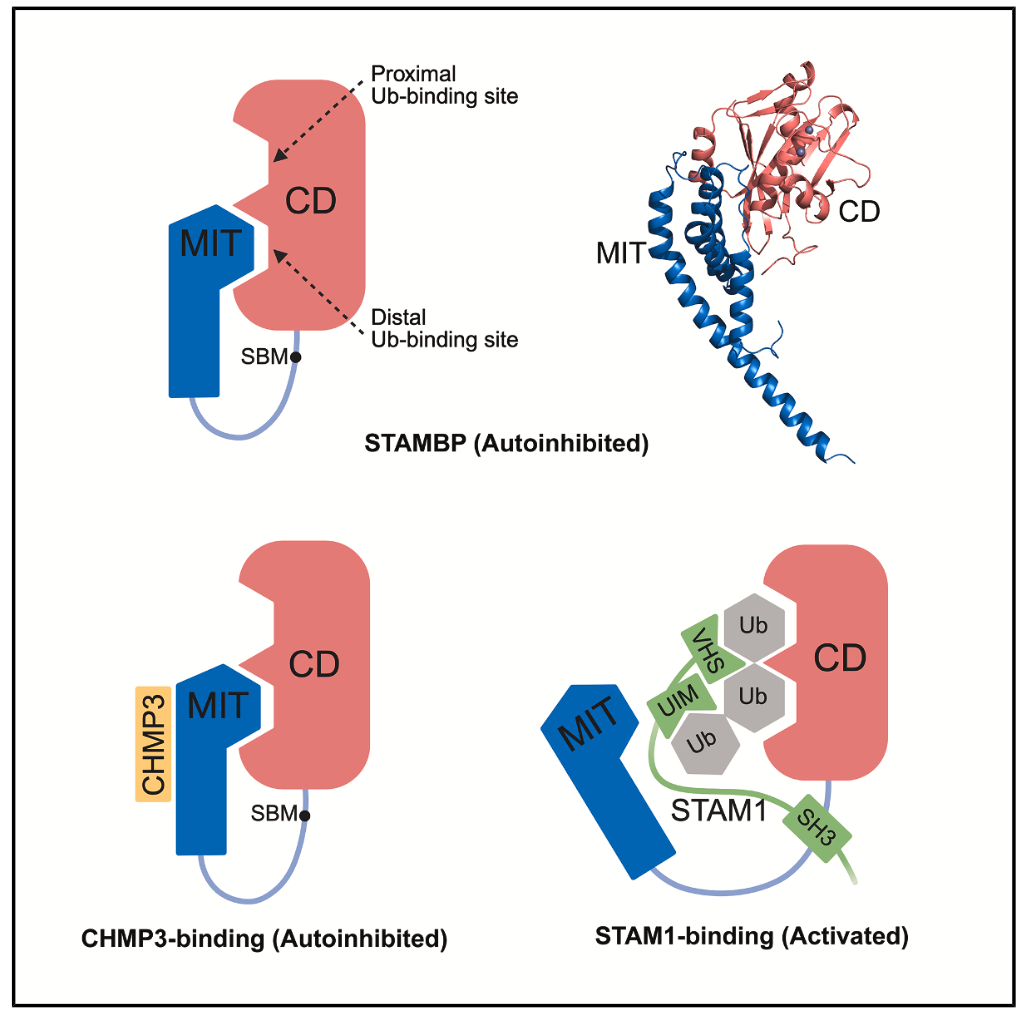
全长STAMBP的自抑制调控机制以及CHMP3和STAM1的结合对其活性的影响
文章链接:https://doi.org/10.1016/j.str.2025.05.001