7月1日,国际学术期刊Nature Communications在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周小龙研究组联合上海交通大学医学院许泓研究组、湖南大学王奕蓉研究组的最新研究成果,题为:“Mammalian tRNA acetylation determines translation efficiency and tRNA quality control”。该项工作揭示了哺乳动物tRNA 乙酰化修饰对mRNA翻译效率及tRNA质量控制的新机制。
tRNA是蛋白质合成的关键接头分子,负责将mRNA遗传信息转换成蛋白质氨基酸信息。tRNA含有位置多样、种类丰富的转录后修饰,精确调控tRNA的折叠、稳定性、密码子-反密码子配对的精准性、tRNA与相关蛋白质的相互作用等,在遗传信息传递的效率与保真性方面发挥关键作用。N4-乙酰胞苷(ac4C)于20世纪60年代率先发现于tRNA分子上。现已发现ac4C广泛存在于原核生物、真核生物与古细菌tRNA、rRNA及小RNA分子中。此外,在mRNA及病毒RNA中也有ac4C修饰的报道。在细菌tRNA中,ac4C只存在于tRNAMet的第34位(ac4C34),其生物学功能是避免tRNAMet的CAG反密码子错误读取异亮氨酸AUA密码子,从而确保翻译的保真性。在古细菌tRNA中,ac4C存在于多个tRNA的多个位置,其丰富伴随生长温度升高而上调,提示其调节了热刺激下的tRNA稳定性。在真核生物tRNA中,ac4C特异性地发生在tRNALeu和tRNASer的C12位(ac4C12), 由RNA乙酰转移酶Nat10/Kre33在非酶辅助因子Thumpd1/Tan1的协同下催化形成。在酿酒酵母中,Tan1基因的缺失会导致在高温条件下,tRNASer(CGA)和tRNASer(UGA)被5’-3’核酸外切酶Xrn1/Rat1通过快速tRNA降解(RTD)途径选择性水解。然而,近60年来,ac4C12 在高等真核生物中的生物学功能尚不清楚。此外,哺乳动物细胞中是否存在RTD途径也不明确。
在本项研究中,研究人员首先明确Nat10与Thumpd1在细胞内直接相互作用,并基于AlphaFold预测的蛋白质结构信息,鉴定了Nat10与Thumpd1相互作用的结构域;纯化了Thumpd1蛋白质,证明Thumpd1可以直接结合底物tRNA;通过CRISPR-Cas9基因编辑系统,构建了Thumpd1基因缺失的NIH/3T3细胞系;Thumpd1的敲除会导致底物tRNA上的ac4C12修饰丧失,证明Thumpd1是tRNA ac4C12形成必不可少的关键辅助因子;在生理条件下,ac4C12的缺失显著下调tRNALeu和tRNASer的氨基酰化水平,该缺陷可以通过过表达相应的亮氨酰-tRNA合成酶和丝氨酰-tRNA合成酶加以拯救;通过翻译组、RNA-seq等技术方法,揭示ac4C12的缺失显著影响全局性翻译效率,尤其是显著抑制富含2个U/A 核苷酸的 Ser/Leu 密码子的解码效率;在热刺激条件下,ac4C12的缺失特异性地导致tRNALeu(CAG)被快速降解;遗传学实验证明,tRNALeu(CAG)的降解是由5’-3’核酸外切酶Xrn1和Xrn2共同介导;进一步研究表明, Bpnt1及Bpnt2通过调控体内代谢物3’,5’-二磷酸腺苷(pAp)的水平,进而调节Xrn1和Xrn2核酸外切酶活性,直接调控tRNALeu(CAG)的快速水解。研究人员将这条受到精细调控的tRNA降解机制命名为mammalian RTD (mRTD)。
总之,该研究结果揭示了哺乳动物细胞tRNA ac4C12修饰在生理条件下对于tRNA氨基酰化以及翻译效率调控的新机制、阐明了ac4C12修饰在热刺激条件下对于tRNA稳定性的决定性作用、建立了哺乳动物细胞tRNA质量控制的新途径。以上研究结果进一步丰富了人们对于tRNA修饰多维度调控mRNA翻译速率与保真性的功能认知。
上海交通大学刘娜博士、湖南大学硕士生刘冰雪、分子细胞卓越中心博士研究生马春蕊为论文的共同第一作者,分子细胞卓越中心周小龙研究员、上海交通大学医学院许泓教授、湖南大学王奕蓉副教授、上海交通大学医学院林瑜副研究员为论文共同通讯作者。感谢分子细胞卓越中心分子生物学技术平台朱南霖博士、细胞库陈跃磊博士的大力支持。该研究得到了中国科学院、科技部、国家自然科学基金委、上海市科委的经费资助。
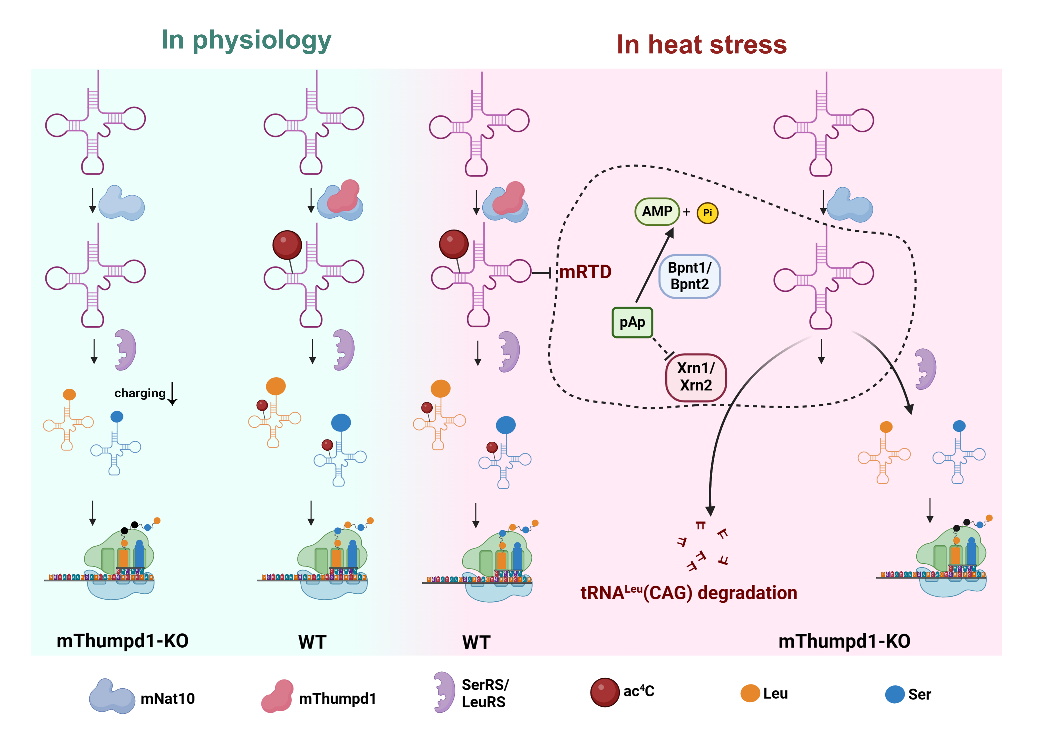
哺乳动物tRNA乙酰化修饰调控翻译效率及tRNA质量控制的新机制
文章链接:https://www.nature.com/articles/s41467-025-60723-3