10月8日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)宋昕阳研究员受邀在国际学术期刊Cell Host & Microbe上发表了题为 "Inter-kingdom lipid messengers sustain gut harmony" 的科学评述(Preview),对同期发表于该期刊题为 "Long-chain unsaturated fatty acids promote trans-kingdom communication during immune responses" 的研究进行了深入解读。
肠道微生物群落的稳定对维持宿主健康至关重要。诸如饮食与药物等外在因素,以及宿主自身免疫激活等内在因素,均可引起肠道菌群结构与功能的变化。在炎症性肠病等病理状态下,菌群失衡及其转录组重塑已有研究报道。然而,共生微生物群落如何特异性响应宿主免疫激活并维持自身稳态,其机制尚未完全阐明。
近日,瑞士日内瓦大学Simone Becattini 实验室的研究成果为该问题的解答提供了新的视角。研究人员通过构建简化的肠道菌群("4-mix"菌群,包含 Enterocloster bolteae、Blautia producta、Parabacteroides distasonis及 Bacteroides thetaiotaomicron四种常见肠道共生菌)定植小鼠模型,结合宿主-微生物转录组联合测序、脂质组学及细胞功能验证实验,揭示了不饱和长链脂肪酸(unsaturated long-chain fatty acids, uLCFAs)及其羟基衍生物作为跨界信使,调控肠道黏膜稳态的关键作用。
研究发现,在细菌鞭毛蛋白诱导的宿主免疫激活模型中,"4-mix"菌群定植的小鼠肠道上皮细胞中磷脂酶编码基因 Pla2g5显著上调。PLA2G5 可特异性水解释放细胞膜磷脂中的油酸(oleic acid, OA)、亚油酸(linoleic acid, LA)等 Δ9-uLCFAs,促进其在肠腔中的积累。实验证据表明,过量的Δ9-uLCFAs 对共生菌具有一定毒性,而 Blautia producta 可通过上调油酸水合酶OhyA的表达,将 OA、LA 分别转化为对共生菌无毒性的 10-羟基脂肪酸(HYB、HYA)。除此以外,HYB 与 HYA 还具备免疫调节活性。体外 T 细胞分化实验显示,HYA 和HYB均可抑制 Th17 细胞中IL-17的产生,而HYB 还可抑制 Th1 细胞 中IFN-γ的产生,提示这些脂肪酸代谢物可作为微生物来源的“免疫刹车分子”,通过抑制炎症因子的表达,避免宿主过度免疫反应造成的损伤。此外,研究者发现给小鼠灌胃OA和LA同样可诱导共生菌中ohyA基因的表达以及HYB、HYA在肠道中的积累,提示膳食uLCFAs亦对共生菌表达谱有直接影响。
该研究系统阐明了“宿主免疫激活—脂质释放—微生物代谢”这一跨物种通讯互作的分子机制,揭示了油酸水合酶OhyA在宿主-微生物对话中的双重功能:一方面解除宿主肠道环境中的脂质毒性以维持菌群生态稳定,另一方面生成具有免疫调节活性的代谢物以缓解宿主过度的炎症反应。这一发现不仅深化了我们对宿主-微生物互作机制的理解,也为未来开发基于脂质代谢调控的益生菌产品或肠道疾病的干预策略提供了新思路。
分子细胞卓越中心宋昕阳研究组研究生侯婧琳为本文的第一作者,宋昕阳研究员为通讯作者。该项工作得到科技部国家重点研发计划、中国科学院B类先导专项、中国科学院“未来伙伴网络专项”、国家自然科学基金委以及上海市科委等部门的经费支持。
文章链接:https://doi.org/10.1016/j.chom.2025.08.011
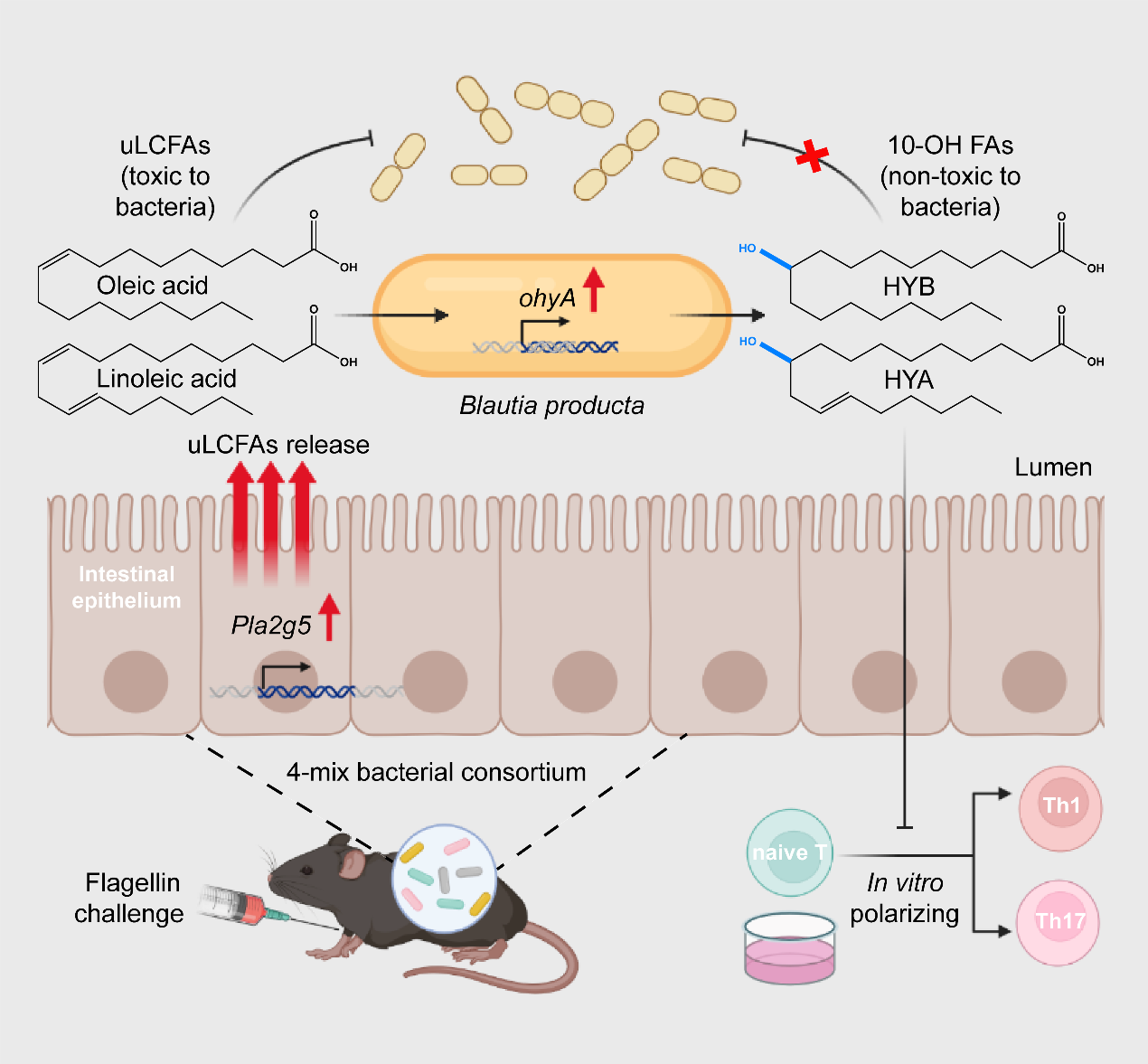
共生菌对机体炎症反应产生的uLCFAs进行解毒以维持菌群稳态并调控宿主免疫反应