6月8日,国际学术期刊EMBO JOURNAL在线发表了中国科学院分子细胞科学卓越创新中心欧阳波团队与美国Oklahoma大学健康科学中心的林家凌团队、加拿大Sunnybrook研究院的David W. Andrews团队的合作研究论文“An amphipathic Bax core dimer forms part of the apoptotic pore wall in the mitochondrial membrane”。该研究通过核磁共振技术解析了促凋亡蛋白Bax的核心结构域在脂双分子层膜上的精确三维结构,并通过结构指导基因突变和体外活性研究证明了该结构在线粒体膜Bax成孔过程中的关键功能。该研究促进了人们对蛋白在膜上成孔的分子机制的理解。
细胞凋亡是维持细胞数量动态平衡的重要手段,凋亡失常将导致许多疾病的发生。Bax是一个关键的促细胞凋亡蛋白,在调控线粒体凋亡途径中发挥着不可或缺的作用。正常情况下,Bax是以单体形式静存于细胞基质中。当细胞接收到凋亡信号后,Bax会被激活并在线粒体膜中形成多聚体孔洞,释放细胞色素C,从而起动凋亡程序。Bax单体是一个由九个α螺旋组成的球状蛋白,激活后会将疏水的α9螺旋释放出来与线粒体膜结合。然而Bax在膜上的状态是什么样的,是如何形成孔洞来改变线粒体通透性进而促进细胞凋亡的,长期以来没有得到解答。
欧阳波团队通过核磁共振技术首次解析了Bax的核心结构域α2-α5双体在脂双分子层类膜体系中的精准三维结构,发现α4和α5形成了一个平整的疏水平面。利用蛋白-磷脂NOE和顺磁探针滴定的方法,进一步确定了的Bax(α2-α5)在膜上的精确位置,发现Bax(α2-α5)α4和α5的疏水平面侧贴于膜之边缘,并与膜形成60o的夹角来最大限度的保护疏水磷脂双层(如图所示),其中R89、F93、F114、A117和S118是与膜相互作用的关键氨基酸。
根据该核磁结构,林家凌团队制备了R89E、F93E、F114E、A117D和S118D的突变,来破坏Bax与膜的静电相互作用或者疏水相互作用,并用脂质体荧光色素释放实验来检测Bax是否还能形成孔洞,结果表明这些突变体都显著地降低了Bax的破膜活性;David W. Andrews团队进一步在细胞中进行了线粒体膜通透性实验,也证实了这些突变体在天然线粒体膜中成孔能力下降。以上这些结构和功能实验揭示了细胞凋亡蛋白Bax在线粒体膜上独特的成孔模式,拓展了人们对成孔蛋白膜上成孔机制的理解。
分子细胞卓越中心博士生吕福娇和温茂荣助理研究员、美国Oklahoma大学齐飞硕士和张志研究助理以及加拿大Sunnybrook研究院Justin Kale博士为本文的共同第一作者。分子细胞卓越中心欧阳波研究员,美国Oklahoma大学健康科学中心林家凌教授和加拿大Sunnybrook研究院David W. Andrews教授为本文的共同通讯作者。该研究得到国家科技部、中国科学院、国家自然科学基金等的资金支持。该研究还得到国家蛋白质科学研究(上海)设施核磁系统的大力协助。
文章链接:https://www.embopress.org/doi/10.15252/embj.2020106438
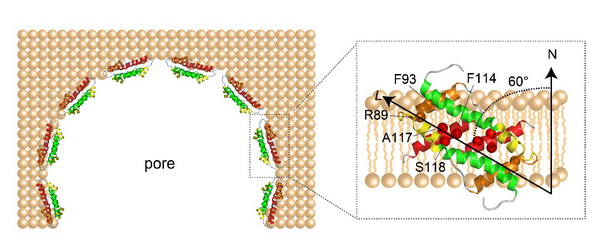
Bax(α2-α5)在线粒体外膜上形成孔洞的模型顶视图(左)和侧贴于脂双层膜的放大图(右)