1月22日,国际学术期刊Nature Chemical Biology在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)杜雅蕊/徐国良研究组联合上海交通大学张良研究组和赛岚医药等多团队的研究成果:“Targeting thymine DNA glycosylase induces synthetic lethality in p53-deficient cancers”。该研究首次揭示靶向TDG可以通过创新性的合成致死机制抑制p53缺失肿瘤的生长并特异性增强抗肿瘤免疫反应,并基于赛岚医药开发的特异性靶向TDG的共价小分子抑制剂C-271进一步阐明了TDG的抗肿瘤合成致死和免疫激活机理。
DNA胸腺嘧啶糖苷酶(Thymidine DNA Glycosylase, TDG)参与DNA碱基切除修复、DNA主动去甲基化以及基因的转录调控等多种生物学过程。该研究组于2011年发现TDG可以切除5mC的氧化产物5fC和5caC,参与DNA主动去甲基化过程。2014年,他们进一步利用体细胞重编程模型,证实TDG介导的去甲基化在细胞命运决定与转换中的重要作用。芝加哥大学何川教授团队等在2014年发表的工作亦首次报道了TDG与DNA底物的复合物结构,为进一步研究TDG的功能和小分子开发打下基础。TDG对胚胎发育至关重要,其缺失将导致小鼠胚胎死亡,而成年后将TDG全身敲除并不会影响小鼠的正常生存。然而,TDG在疾病中如何发挥功能尚不清楚。在肿瘤中,TDG相对于正常细胞显著高表达,且其高表达与不良预后高度相关,但其在肿瘤发生中的作用尚不清晰,有报道称TDG在结肠癌和黑色素瘤等肿瘤中可能扮演促癌的角色,而在肝癌等肿瘤中则有可能扮演抑癌的功能。这些工作提示TDG与肿瘤发生和发展密切相关,但其在不同肿瘤中的调控机制以及靶向治疗的应用前景仍有待进一步探究。此外,抑制表观遗传机制有望通过viral mimicry机制激活肿瘤先天免疫,例如DNMT、HDAC、LSD1等靶点的小分子抑制剂,已有多项研究报道;但如何特异地仅激活肿瘤细胞的先天免疫,仍是阻碍表观遗传药物应用在肿瘤开发,特别是实体瘤开发的关键问题。
P53的点突变和缺失在多种肿瘤中广泛存在,且在所有肿瘤类型中占比过半,部分癌种如小细胞肺癌、卵巢癌等甚至高达70-90%。作为经典的肿瘤抑制基因,P53难以通过靶向开发小分子抑制剂进行治疗,因此携带P53突变的肿瘤患者亟需创新药物和疗法以应对临床治疗挑战。本研究中,研究人员发现TDG是p53缺失肿瘤中的一个新型合成致死靶点。敲除TDG可抑制p53缺失肿瘤细胞的增殖,而对于p53野生型的肿瘤细胞则没有任何影响。该现象在KrasG12D驱动的小鼠肺腺癌模型以及多种人肿瘤细胞系中均得到了验证。机制上,研究人员发现TDG和p53在转录调控方面功能互补,两者均作用于RNA解旋酶DHX9的启动子区域并促进其转录,维持DHX9的稳定表达。在p53缺失的肿瘤细胞中,TDG加强了对DHX9的转录激活,弥补了p53的缺失,而抑制TDG则导致DHX9表达下调,从而引发异常的dsRNA积累,激活RIG-I/MDA5–MAVS信号通路,最终实现肿瘤抑制并增强抗肿瘤免疫。
鉴于TDG是一个典型的DNA结合蛋白,研究人员通过构建DNA结合能力减弱的突变体,证明干预TDG与DNA的结合可以有效抑制p53缺失肿瘤的生长。作为一个核苷酸修饰酶,TDG的DNA结合口袋特性对于TDG特异的小分子筛选和成药性优化极具挑战。基于此,研究团队进一步联合赛岚医药的研发团队自主开发了高通量筛选方法,并通过赛岚医药团队的小分子发现、药物化学优化和临床前开发努力,首次在全球成功获得了特异性阻断TDG与DNA结合的共价小分子抑制剂C-271。此后,上海交通大学张良团队通过TDG与小分子的共晶结构,高分辨率地解析了该工具化合物C-271靶向TDG的分子基础。进一步实验证明该工具化合物小分子具有优异的生化活性,对多种TP53突变的肿瘤均有抑制细胞增殖的效果,并显著增强抗免疫检查点抑制剂(CTLA-4抗体)的治疗效果。C-271的单药治疗以及联合免疫治疗对三阴性乳腺癌、非小细胞肺癌、恶性黑色素瘤等实体瘤的疗效尤为出色。上海肺科医院任胜祥主任团队利用非小细胞肺癌鳞癌等病人样品合作证明肿瘤中TDG水平与临床获益程度之间存在负相关性。以上结果暗示TDG 抑制剂与 ICB 联合使用可能成为 p53 缺乏型癌症治疗的有效策略。此外,以该工具化合物为代表的TDG的小分子抑制剂在临床前研究中已显示出良好的安全性、治疗窗口和卓越的成药性,为后续的临床开发(包括单药和联合免疫治疗)奠定了坚实基础。
值得一提的是,针对这项研究,Nature Chemical Biology同期配发了瑞士巴塞尔大学生物医学系Simon D. Schwarz博士的News&Views评述:“Targeting transcriptional plasticity in cancer”(https://doi.org/10.1038/s41589-025-02101-0)。该评述指出,周嘉信等人的研究揭示了癌症中转录或表观遗传调控因子与突变抑癌基因之间的相互作用。通过干扰TDG糖苷酶,在p53缺失的癌细胞中产生了独特的合成致死现象,这一过程涉及RNA解旋酶DHX9的失调。该发现不仅为开发first-in-class TDG抑制剂提供了启示,还通过C-271的发现,提供了一个有力的工具,能够在临床和基础研究中调控TDG活性。
分子细胞卓越中心杜雅蕊研究员、徐国良院士、上海交通大学张良教授、赛岚医药吴海平博士为该论文共同通讯作者。分子细胞卓越中心周嘉信博士、邵震宇博士、上海交通大学张琳副研究员以及赛岚医药郭剑南博士和王猛博士为该论文共同第一作者。西湖大学季红斌研究员、上海肺科医院任胜祥主任对该工作给予了大力支持。该工作得到了中国科学院、基金委、科技部、上海市科委等部门的经费资助以及分子细胞卓越中心动物平台、化学平台和细胞平台的帮助与支持。赛岚医药完成了对小分子的发现和临床前开发,并提供了充足的资源支持和知识产权保护。据悉,赛岚医药将进一步推动临床前研发,尽快将TDG的候选小分子化合物推进到临床阶段,期待给携带P53突变的肿瘤患者带来新的治疗手段和获益,并打造中国原创机理、全球原创分子的“双原创”重磅药物。
文章链接:https://www.nature.com/articles/s41589-025-02100-1
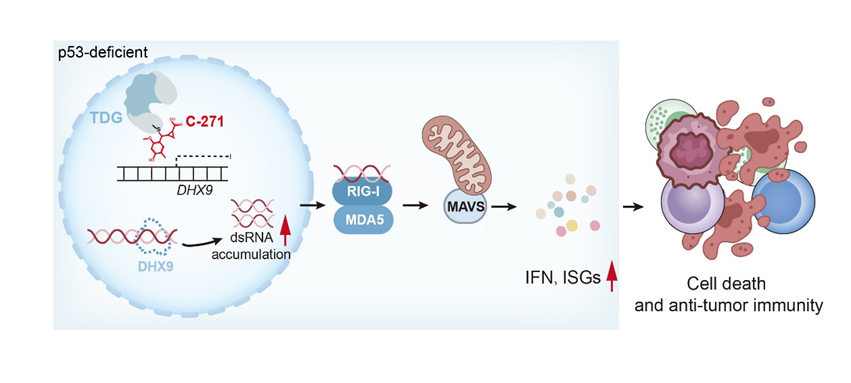
靶向TDG抑制p53缺失肿瘤的工作模型