1月21日,国际学术期刊Nature Communications在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)杨巍维研究组与温州医科大学附属第一医院李文峰团队以及辽宁师范大学化学与生物学交叉研究中心李国辉团队的合作研究成果:“An alternative EGFR activation by patient-derived R252C mutation promotes cancer progression”。该研究发现了一种新的EGFR突变体(EGFR R252C),揭示了其通过直接磷酸化并激活ERK1/2促进肿瘤进展的新功能,并验证了阿法替尼对该突变肿瘤的临床治疗潜力。
表皮生长因子受体(EGFR)是肺癌等多种恶性肿瘤的关键致癌驱动基因。针对其经典突变类型(如L858R点突变和外显子19缺失),已有系列靶向药物成功应用于临床。然而,部分患者携带的EGFR罕见突变亚型,其致癌分子机制阐释尚不充分,导致临床治疗反应不佳。因此,识别并阐明罕见EGFR突变的致病机制,是当前肿瘤精准医疗领域亟待突破的难点之一。
研究的起点是一名同时罹患肺癌和脑胶质瘤的患者。通过基因测序,研究团队在其肿瘤样本中发现了一个EGFR罕见突变:位于细胞外区域的第252位精氨酸(R)突变为半胱氨酸(C),即EGFR R252C。值得注意的是,该突变在公共癌症基因组数据库中虽有记录,但其在肿瘤中的具体生物学功能与机制尚不明确。因此,探究EGFR R252C是否及如何驱动肿瘤生长,构成了本研究的核心科学问题。
传统认知中,EGFR与配体EGF结合后,可通过二聚化并发生自身磷酸化,从而启动下游信号通路。该研究发现,在无配体结合条件下,R252C突变会像一把“分子锁”一样,通过新形成的二硫键(C252-C252)直接将两个EGFR分子牢牢锁在一起,形成稳定的二聚体。这种异常的二聚化引发了EGFR受体结构的改变,使得突变后的EGFR本身几乎不发生自磷酸化,但它却能够绕过经典步骤,直接与下游的关键信号分子ERK1/2结合,磷酸化并激活ERK1/2,从而促进体内肿瘤细胞增殖和肿瘤生长。通过进一步的药物筛选和分析,他们发现第二代EGFR酪氨酸激酶抑制剂阿法替尼(Afatinib)能够有效抑制由EGFR R252C突变驱动的ERK1/2活化和肿瘤生长。在针对该患者的个案治疗中,阿法替尼的使用成功地控制了其多发性肺癌和胶质瘤的进展,延长了无进展生存期。
本研究不仅从机制层面解释了这一罕见EGFR突变的致癌性,也为携带该突变的患者提供了直接可行的治疗选择,有望快速实现临床转化与患者获益。
分子细胞卓越中心杨巍维研究员、温州医科大学附属第一医院李文峰主任医师和辽宁师范大学化学与生物学交叉研究中心楚慧郢教授为该论文的共同通讯作者。上海市胸科医院张亚娟副研究员、费麒祯、辽宁师范大学化学与生物学交叉研究中心李焱副教授及分子细胞卓越中心王思瑶博士为该论文的共同第一作者。该项工作获得科技部、国家自然科学基金、中国科学院、上海市科委、尚思探索学者基金会的项目资助。该项研究工作得到了分子细胞卓越中心细胞生物学技术平台、分子生物学技术平台和动物实验技术平台的支持。
文章链接:https://www.nature.com/articles/s41467-026-68699-4
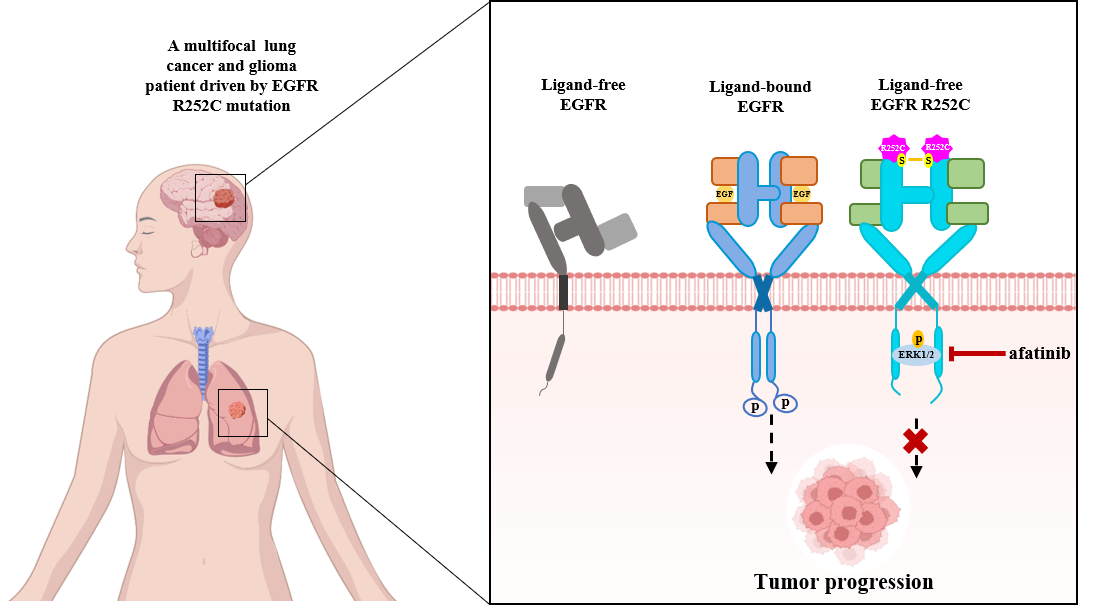
患者来源的R252C突变对EGFR的替代激活促进癌症进展