1月6日,国际学术期刊Theranostics在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)赵允研究组的研究成果:“Hilnc-mediated UCP1 translation repression contributes to thermogenesis and energy expenditure”。该研究揭示了长链非编码RNA Hilnc通过结合Ucp1 mRNA并招募胰岛素样生长因子2结合蛋白2(IGF2BP2),在翻译水平抑制产热关键蛋白UCP1的表达,从而精细调控米色脂肪细胞的产热能力。这一发现不仅拓展了对脂肪组织产热调控网络的理解,也为针对肥胖等相关代谢性疾病的治疗提供了新的潜在靶点。
米色脂肪细胞在低温等刺激下能通过上调表达解偶联蛋白1(UCP1)进行产热,在体温调节和能量平衡中扮演关键角色。尽管UCP1的转录调控已被广泛研究,但其转录后调控机制,尤其是翻译水平的调控,尚不清晰。长链非编码RNA(lncRNA)作为一类重要的调控分子,在代谢过程中发挥多重作用,但其是否以及如何参与UCP1的翻译调控仍是未知领域。
该研究组前期研究表明,Hh信号通路可通过直接调控一个此前未定义的长链非编码RNA Hilnc(Hedgehog induced long non-coding RNA),参与高脂饮食诱导的肝脏脂质代谢调控(Nature Metabolism 2021)。本研究中,研究人员进一步发现,脂肪细胞特异性敲除Hilnc的小鼠表现出更高的能量消耗、更高的体温、更小的腹股沟白色脂肪组织体积,并伴随UCP1蛋白水平的显著升高。机制研究表明,Hilnc能够直接结合到Ucp1 mRNA的3'非翻译区(3'UTR),并作为“分子支架”招募RNA结合蛋白IGF2BP2,共同抑制Ucp1 mRNA的翻译过程,而不影响其mRNA的稳定性。这一调控机制在人类脂肪组织中同样保守。研究人员此前鉴定的人类Hilnc功能同源物(h-Hilnc)在人体脂肪组织中的表达水平与UCP1蛋白含量呈负相关,并能通过相似机制抑制UCP1的翻译。
该研究深入解析了Hilnc抑制翻译的分子细节。当破坏Hilnc中与Ucp1 mRNA结合的关键区域后,IGF2BP2无法被有效招募至Ucp1 mRNA,其翻译抑制效应也随之解除。这种不依赖于mRNA降解的翻译抑制模式,类似于微小RNA(miRNA)的作用,但由lncRNA介导,揭示了一种新的转录后调控范式。尤为重要的是,Hilnc在棕色脂肪和不同的白色脂肪库中表达模式存在差异,其特异性调控米色脂肪细胞中UCP1的翻译,提示棕色与米色脂肪细胞尽管功能相似,但可能受到截然不同的转录后调控网络支配,这为理解全身产热调控的复杂性提供了新视角。
这项研究的发现具有重要的生理与转化医学意义。在基础研究层面,它阐明了lncRNA可通过招募蛋白因子在翻译水平直接调控UCP1,为理解脂肪细胞功能及全身能量代谢的精细调控开辟了新方向。在应用层面,由于UCP1是抵抗肥胖等代谢疾病的潜在治疗靶点,靶向Hilnc或其与IGF2BP2/Ucp1 mRNA的相互作用位点,有望成为解除UCP1翻译抑制、特异性激活米色脂肪产热功能的新策略,为开发治疗肥胖及相关代谢并发症的创新疗法提供了理论依据和新的分子靶点。
分子细胞卓越中心赵允研究员、美国德州大学西南医学中心张召教授、杨浦区中心医院常毅博士和分子细胞卓越中心博士后李愚为该论文的通讯作者。上海科技大学博士生姜曼、分子细胞卓越中心博士后李愚和德州大学西南医学中心博士后蒋怡翱为该论文的第一作者。该研究得到国家自然科学基金委、科技部、中国科学院、上海市等的经费支持,还得到了分子细胞卓越中心动物平台、细胞平台和分子平台等技术平台的支持。
文章链接:https://www.thno.org/v16p3263.htm
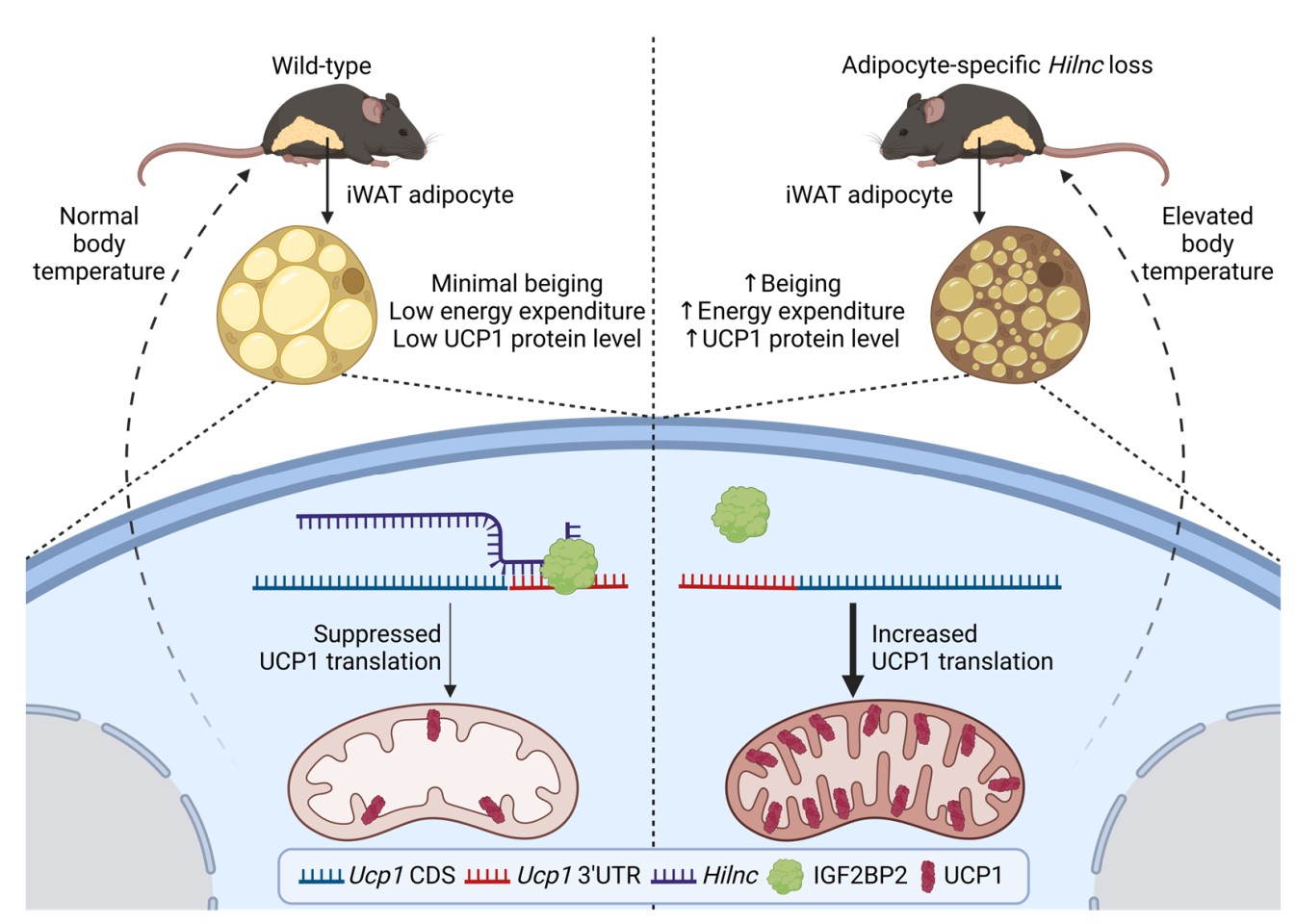
Hilnc通过招募IGF2BP2抑制Ucp1 mRNA翻译,发挥负调控米色脂肪产热与能量稳态的作用